Currently this content is only available in English.
Dieser Inhalt ist momentan nur auf Englisch verfügbar.
Die Medgate Kids Line liefert schnell und unkompliziert medizinischen Rat, wenn es Ihrem Kind nicht gut geht. Rund um die Uhr steht Ihnen das medizinische Team unseres Partners Medgate telefonisch zur Verfügung.
0900 712 712 (3.23 CHF / Min.)
nur über private Festnetz- oder Handynummern
0900 712 713 (3.23 CHF / Min.)
für Anrufe von Prepaid-Handys
Notfälle im Ausland
Bei Notfällen im Ausland rufen Sie die Notfallnummer Ihrer Krankenkasse an. Diese finden Sie jeweils auf Ihrer Krankenkassenkarte.
Notfallnummern
Beratungstelefon für Kinder- und Jugendnotfälle
Die Medgate Kids Line liefert schnell und unkompliziert medizinischen Rat, wenn es Ihrem Kind nicht gut geht. Rund um die Uhr steht Ihnen das medizinische Team unseres Partners Medgate telefonisch zur Verfügung.
0900 712 712 (3.23 CHF / Min.)
Festnetz und Handy-Abo
0900 712 713 (3.23 CHF / Min.)
Prepaid-Handys
0800 444 333 (Kosten werden über Krankenversicherung abgerechnet)
Für Business-Anschlüsse
Notfälle im Ausland
Rufen Sie die Notfallnummer Ihrer Krankenkasse an. Diese finden Sie jeweils auf Ihrer Krankenkassenkarte.
Wichtige Notfallnummern
- 144 Ambulanz
- 145 Tox Info Suisse (Vergiftungen)
- 117 Polizei
- 118 Feuerwehr
Notfallstation UKBB
Kontakt Box
Kontakt
Zu welchem Thema möchten Sie uns kontaktieren?
Für Lob oder Tadel nutzen Sie bitte das Feedback-Formular.
Terminvereinbarung sind nicht über das Kontaktformular möglich. Für Terminvereinbarungen und -verschiebungen wenden Sie sich bitte an die Leitstelle Poliklinik +41 61 704 12 20
Mahnung / Inkasso
Patientenabrechnung
Bitte kontaktieren Sie mich
Sonstiges
Gehirn
Hier stellen wir Ihnen eine kleine Auswahl typischer Krankheitsbilder vor, welche die Pädiatrische Neurochirurgie am UKBB mit modernsten Methoden behandelt.
Kraniosynostosen (Frühzeitiger Verschluss von Schädelnähten)
Die wichtigsten Punkte
- Eine Kraniosynostose ist ein vorzeitiger Verschluss der Schädelnähte die zu einer veränderten Kopfform führt.
- Die genaue Ursache ist unbekannt.
- Das typische klinische Zeichen ist eine veränderte bzw. abnormale Kopfform.
- Die chirurgische Behandlung ist die Therapie der Wahl, mit dem Ziel, eine möglichst normale Kopfform wiederherzustellen.
- Die Prognose ist insgesamt exzellent.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was sind Kraniosynostosen bzw. was bedeutet ein frühzeitiger Verschluss von Schädelnähten?
Der menschliche Schädel besteht aus mehreren Schädelknochen, die an sogenannten Schädelnähten zusammenkommen und zusammenwachsen. Bis zur frühen Kindheit sind diese Schädelnähte offen, damit ein ungehindertes Wachstum des Gehirns stattfinden kann. Später verschliessen sie sich.
Der Schädel weist vier grosse Schädelnähte auf: die metopische Naht (Stirnnaht), die Koronarnaht (Kranznaht), die Saggitalnaht (Pfeilnaht) und die Lambdoidnaht (Lambdanaht). Verschliesst sich eine dieser Schädelnähte vorzeitig, spricht man auch von einer Kraniosynostose. Es können sich auch mehrere Schädelnähte gleichzeitig frühzeitig verschliessen. Auf ca. 2000 bis 2500 Geburten ist weltweit ein Kind von Kraniosynostosen betroffen. Die genaue Ursache für Kraniosynostosen ist nicht bekannt. Am häufigsten tritt sie sporadisch (zufällig) auf. Sie kann aber auch im Rahmen von seltenen kranio-fazialen Syndromen auftreten, die den Schädel und das Gesicht betreffen. Beispiele sind etwa das Apert-, Pfeiffer-, oder Crouzon-Syndrom. Durch den vorzeitigen Verschluss kommt es zu einer veränderten Schädelform, was unter Umständen die Ausdehnung und Entwicklung des Gehirns hemmen kann.
Typische Formen
In der Kinderneurochirurgie unterscheiden wir zwischen den vier häufigsten Schädelverformungen:
- Die Sagittalnaht-Synostose führt zu einem sogenannten «Kahnschädel» (Scaphocephalus). Dies ist bei weitem die häufigste Kraniosynostose und kommt in 1:5’000 Geburten vor.
- Die Koronarnaht-Synostose führt zu einem sogenannten «vorderen Schiefkopf» (Plagiocephalus). Sie kann einseitig oder beidseitig sein. Diese Form kommt in 1:11'000 Geburten vor.
- Die Synostose der metopischen Naht führt zu einem sogenannten «Dreieckschädel» (Trigonocephalus). Diese Form kommt in 1:15'000 Geburten vor.
- Die Lambdanaht-Synostose führt zu einem «hinteren Schiefkopf» (Plagiocephalus). Diese Form ist sehr selten und kommt in 1:200'000 Geburten vor.
Viel häufiger als Kraniosynostosen treten Schädelverformungen auf, die durch eine lange Rückenlage des Kindes verursacht werden. Die sogenannte «lagebedingte Plagiozephalie» ist in der Regel reversibel und benötigt keine kinderneurochirurgische Behandlung. Es ist weder eine Entwicklungsstörung noch erhöhter Hirndruck zu erwarten.
Manchmal als Kraniosynostose interpretiert werden kann zudem fälschlicherweise, wenn sich auf dem Schädel im frühen Kindesalter ein tastbarer Kamm bildet. Solch ein «benign metopic ridge» entsteht jedoch beim normalen Verschluss der metopischen Naht. Dies benötigt ebenfalls keine neurochirurgische Behandlung.
Seltenere Formen
Generell unterschieden wird zwischen einer Einzelnahtsynostose (single suture synostosis) und einer Synostose von mehrerer Nähten (multi suture synostosis). Einzelnahtsynostosen sind in der Regel nicht familiär bedingt und treten meistens sporadisch auf. Synostosen von mehreren Nähten dagegen treten oft familiär bedingt auf. Sie können aber auch im Rahmen von typischen Syndromen vorkommen.
Kraniosynostosen im Rahmen von Syndromen sind relativ selten. Dabei handelt es sich meistens um zufällige neu aufgetretene Genmutationen. Bei diesen Kindern sind oft mehrere Schädelnähte gleichzeitig betroffen, wobei im Rahmen des Syndroms häufig auch andere Körperteile, wie z.B. das Gesicht, die Hände, die Füsse etc., betroffen sind und auch dementsprechend behandelt werden müssen. Die Syndrome, bei denen Kraniosynostosen am häufigsten auftreten, sind das Apert-Syndrom, das Crouzon- Syndrom, das Pfeiffer-Syndrom, das Carpenter-Syndrom und das Saethre-Chotzen-Syndrom.
Das Apert-Syndrom tritt in etwa 6 bis 15.5 auf 1 Million Geburten auf und zeigt sich insbesondere mit einer beidseitigen Koronarnaht-Synostose und einem unterentwickelten Oberkieferknochen.
Das Crouzon-Syndrom tritt in etwa 16 auf 1 Million Geburten auf und äussert sich ebenfalls besonders durch eine beidseitige Koronarnaht-Synostose.
Das Pfeiffer-Syndrom ist sehr selten und kommt in drei verschiedenen Formen vor, wobei man jeweils die Ausprägung der Begleiterkrankungen unterscheidet. Beim Pfeiffer-Syndrom liegt ebenfalls eine beidseitige Koronarnaht-Synostose vor.
Das Carpenter-Syndrom und das Saethre-Chotzen-Syndrom sind extrem selten und zeigen sich insbesondere durch Kraniosynostosen der Koronar-, Sagittal- und Lambdanaht (Carpenter Syndrom) bzw. der Koronar-, metopischen- und Lambdanaht.
Symptome
Was sind typische Zeichen von Kraniosynostosen?
Kraniosynostosen werden typischerweise innerhalb der ersten Lebensmonate durch eine auffällige oder veränderte Kopfform festgestellt. Wird eine Kraniosynostose nicht rechtzeitig behandelt, kann es in sehr seltenen Fällen aufgrund verengter Platzverhältnisse im Kopf zu Symptomen eines erhöhten Hirndrucks kommen. Betroffene Kinder beschweren sich in diesen Fällen über Kopfschmerzen, müssen erbrechen und zeigen eine leichte Reizbarkeit, Gewichtsverluste oder Appetitlosigkeit sowie eine verzögerte Entwicklung, Sehstörungen oder kognitive Einschränkungen. Zusätzlich können Kraniosynostosen die Kopfformen verändern, wodurch es zu einem ästhetisch unbefriedigenden Erscheinungsbild kommen kann.
Diagnose
Welche weiterführende Diagnostik ist bei Verdacht auf Kraniosynostose notwendig?
In der Regel wird eine Kraniosynostose anhand des klinischen Erscheinungsbildes (der typischen Zeichen einer Kraniosynostose) und der sichtbaren Kopfform diagnostiziert. Daher ist häufig keine Bildgebung notwendig. Ein Ultraschall der Schädelnähte kann die Diagnose einer Kraniosynostose festigen, ist aber in den meisten Fall nicht notwendig. Auf ein Röntgenbild kann heute verzichtet werden. Ein Computer Tomogramm (CT) ist nur dann sinnvoll, wenn eine Kraniosynostose der metopischen oder koronaren Naht vorliegt, damit die offene Operation geplant werden kann.
Falls bei Ihrem Kind der Verdacht auf eine genetische Form der Kraniosynostose besteht, wird eine*r unserer Expert*innen für Genetik Sie beraten und je nach Bedarf zu den jeweiligen Spezialist*innen am UKBB zuweisen.
Therapie
Wie lässt sich eine Kraniosynostose behandeln?
Die Therapie der Wahl bei einer diagnostizierten Kraniosynostose ist die chirurgische Korrektur der Schädelform. Die Operationstechnik unterscheidet sich dabei je nach Art der Kraniosynostose.
Prinzipiell können alle Formen der Kraniosynostose minimal-invasiv mit einem kameragesteuerten Endoskop oder offen operiert werden. Die endoskopische Technik benötigt einen kleineren Hautschnitt und nach der Operation wird die Schädelformung mit einem individuell angepassten Helm unterstützt.
Minimal-invasive
(endoskopische) Operationstechnik:
Der ideale Zeitraum für eine endoskopische Operation liegt innerhalb der ersten drei bis maximal vier Lebensmonate. Daher, muss für diese Operationstechnik die Diagnose entsprechend frühzeitig gestellt worden sein. Die endoskopische Operation dauert ca. 60 bis 90 Minuten. Dabei wird das Kind in Rückenlage gelegt und es werden ein bis zwei kleine (ca. 3 cm lange) Hautschnitte an der Kopfhaut gemacht, durch welche die Operationsinstrumente eingeführt werden können. Unter endoskopischer Sicht werden zunächst Haut und Knochenhaut (Periost) oberhalb vom Schädelknochen abgelöst, danach die Hirnhaut (Dura) unterhalb vom Knochen abgelöst, damit diese geschützt werden kann und unverletzt bleibt. Ein ca. 2 cm breiter Knochenstreifen entlang der betroffenen Naht wird entfernt und damit die verschlossene Schädelnaht wiedereröffnet. Aktive Blutungen werden gestillt und die Hautschnitte wieder zugenäht. Nach der Operation wird die Normalisierung der Schädelform mithilfe eines individuell angepassten Helms unterstützt. Dieser Helm muss 23 Stunden pro Tag währen 9 bis 12 Monaten getragen werden. Komplikationen treten bei dieser Operation selten auf (Blutungen und Infektion bei weniger als 1% der Kinder) und der Blutverlust während der Operation ist in der Regel gering.
Offene Operationsmethode:
Die offene Kraniosynostosen-Operation wird idealerweise zwischen dem 6. bis 9. Lebensmonat durchgeführt. Hier unterscheidet sich die Operationstechnik je nach Synostose-Form.
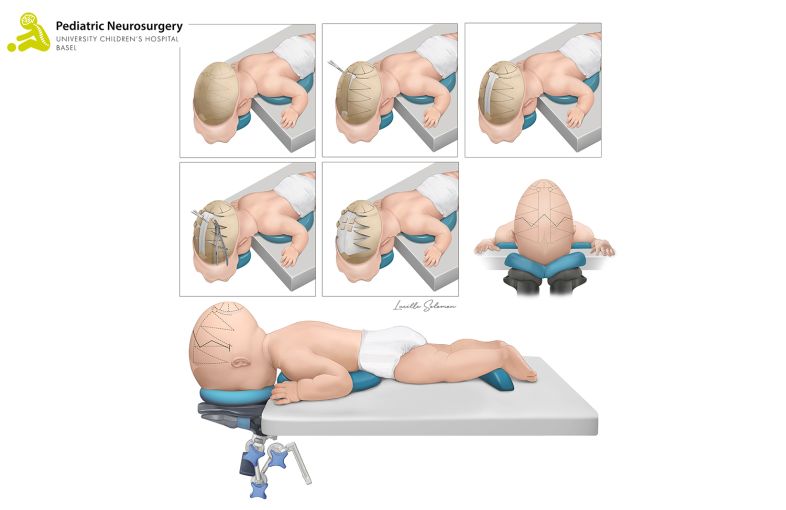
- Bei der offenen Operation einer Sagittalnaht-Synostose wird das Kind in Bauchlage operiert. Es wird ein zickzack-förmiger Hautschnitt von Ohr zu Ohr durchgeführt. Der darunterliegende Knochen wird von den Muskeln und der Haut befreit. Danach wird im Bereich der verschlossenen Sagittalnaht ein ca. 4 cm breiter Knochenstreifen herausgeschnitten. Zusätzlich wird der Schädelknochen seitlich auf beiden Seiten aufgesägt und mittels einer Knochenzange nach aussen gebogen, damit die spätere Kopfform weniger schmal wird. Im hinteren Bereich des Schädels wird ein runder Knochenschnitt durchgeführt, damit sich die oftmals sehr prominente hintere Schädelpartie zurückbilden kann. Anschliessend wird ein kleiner Schlauch unter der Haut platziert, damit allfälliges Blut über 24 bis 48 Stunden abfliessen kann. Die Haut wird im Anschluss zugenäht. Die Operation dauert im Durchschnitt rund 90 Minuten. Die Risiken sind ähnlich der endoskopischen Technik, bei der offenen Operation kommt es jedoch zu einem vermehrten Blutverlust während der Operation, was häufig die Gabe von Blut (Bluttransfusion) erfordert.
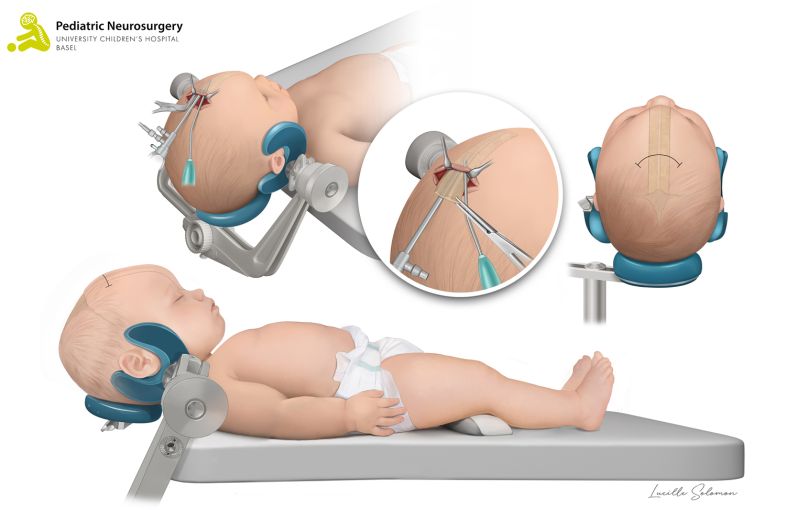
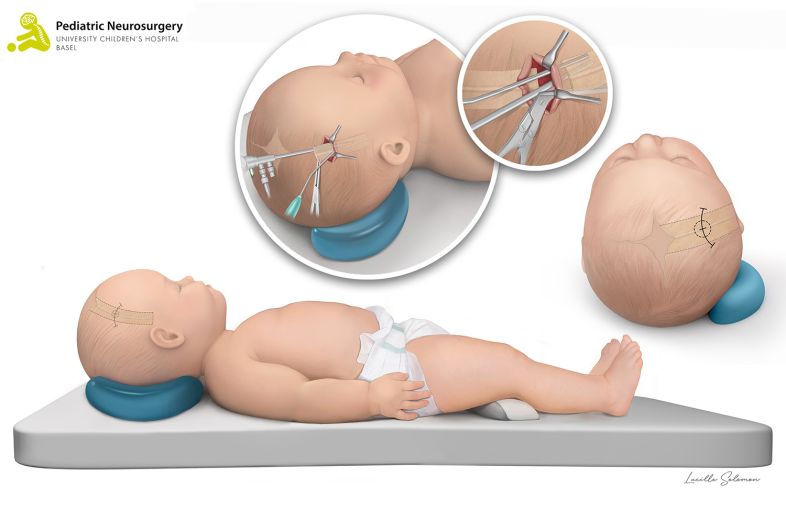
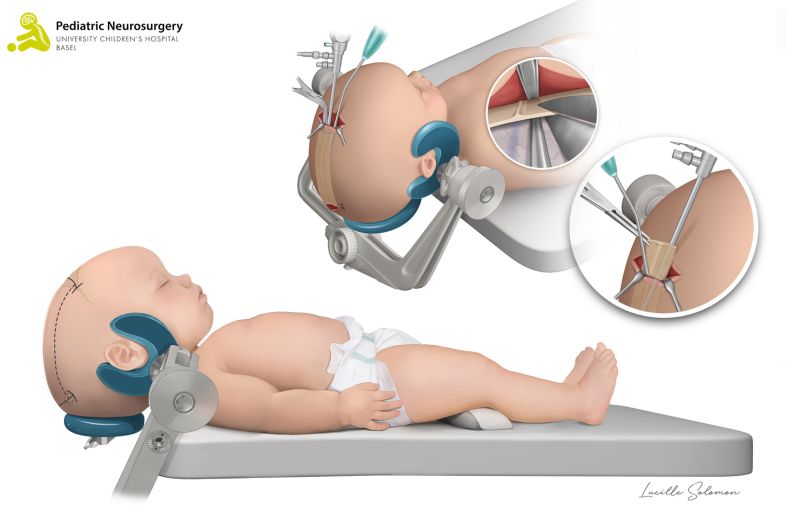
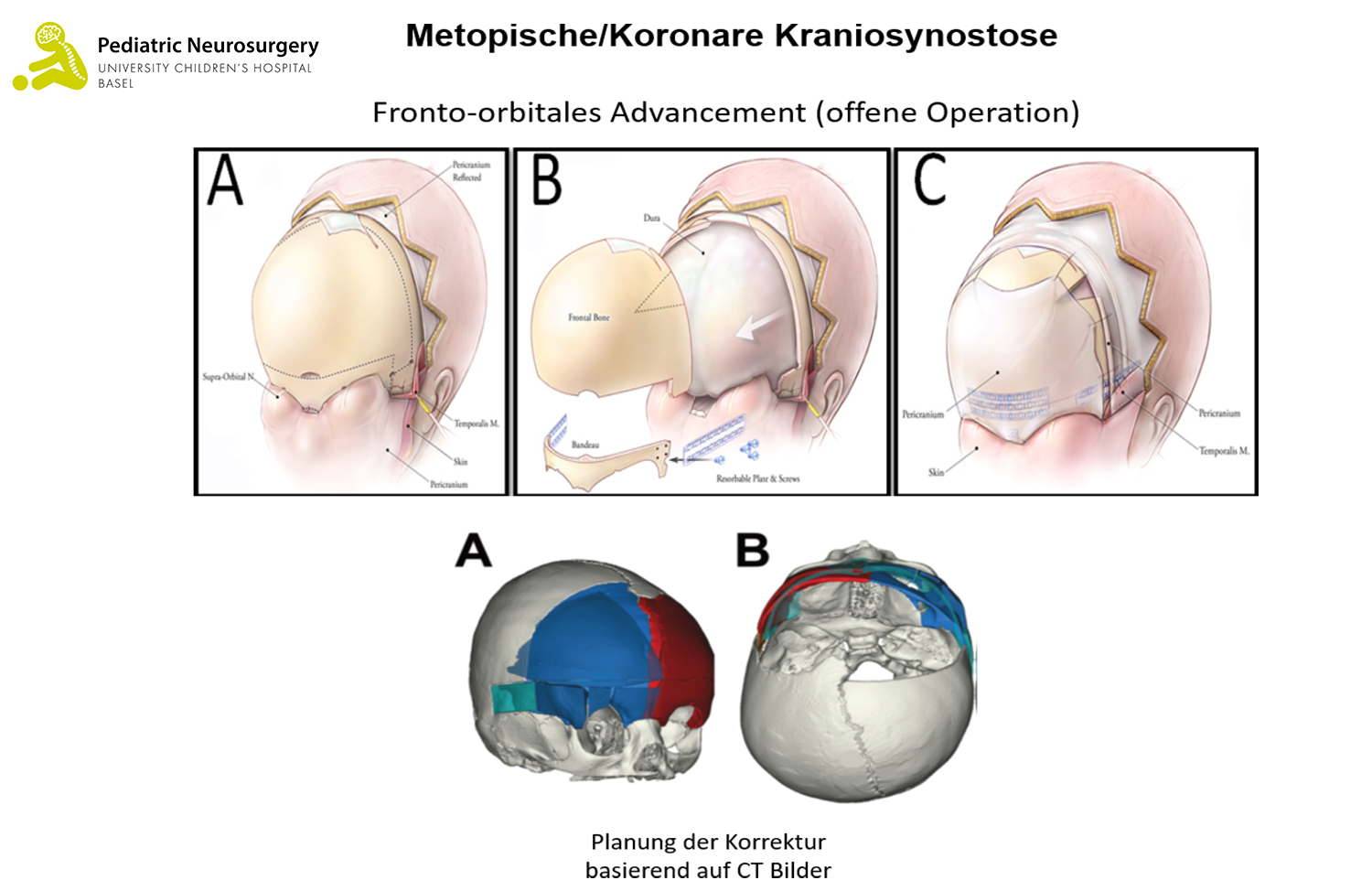
- Die offene Operation bei einer Kraniosynostose der Koronarnaht und der metopischen Naht wird als «Fronto-Orbitales Advancement» bezeichnet. Bei uns im UKBB wird die Korrektur dieser Kraniosynostosen mithilfe eines Computerprogramms im Vorfeld der Operation geplant. Darauf basierend werden exakt vorgefertigte und sterilisierte dreidimensional (3D) gedruckte Schablonen während der Operation angewendet, um die Operationsplanung millimetergenau umzusetzen. Diese Methode wird schweizweit nur bei uns im UKBB und weltweit nur in einzelnen spezialisierten Zentren genutzt. Das Kind wird in Rückenlage platziert. Es wird ein zickzack förmiger Hautschnitt von Ohr zu Ohr durchgeführt. Danach wird der Knochen der Stirn sowie der Knochen oberhalb der Augen (sogenanntes fronto-orbitales Bandeau) entfernt. Anhand der vorgefertigten patientenspezifischen Schablonen der Knochen wird das fronto-orbitale Bandeau rekonstruiert und mit resorbierbaren Mini-Platten und -Schrauben an den Schädel fixiert. Damit allfälliges Blut während 24 bis 48 Stunden ablaufen kann, wird ein kleiner Schlauch unter der Haut eingelegt. Anschliessend wird die Haut mit selbstauflösenden Fäden wieder zugenäht. Die Operation dauert im Durchschnitt rund 240 Minuten (4 Stunden). Die Risiken sind ähnlich der endoskopischen Technik, bei der offenen Operation kommt es jedoch zu einem vermehrten Blutverlust während der Operation, was häufig die Gabe von Blut (Bluttransfusion) erfordert.
Operationsrisiken
Allgemein sind die Risiken der Operation gering (<1 Prozent) und beschränken sich auf Wundinfektionen, Narbenbildung, Blutungen und die Risiken der Anästhesie.
Bei einer offenen Operation besteht ein relativ hohes Risiko, dass aufgrund des Blutverlusts während der Operation eine Bluttransfusion erforderlich wird. Dies ist bei rund zwei Dritteln der Fall. Bei einer minimal-invasiven (endoskopischen) Methode ist dieses Risiko deutlich geringer.
Unser kinderneurochirurgisches Team am UKBB verfügt über eine langjährige und sehr viel Erfahrung in der offenen wie auch in der minimal-invasiven (endoskopischen) chirurgischen Behandlung von Kraniosynostosen. Unsere Kolleg*innen der Kieferchirurgie unterstützen uns bei diesen Operationen wie auch bei der Behandlung mittels Helm nach der Operation. Zusammen bilden wir ein national und international renommiertes kranio-faziales Zentrum mit einem Team, das auf höchstem Niveau mit den neusten Techniken und Operationsmethoden, mit grösster Kompetenz, aber auch mit grosser Empathie und Leidenschaft unsere kleinen Patient*innen mit diesen Krankheitsbildern behandelt.
Spitalaufenthalt
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der Pädiatrischen Neurochirurgie im UKBB betreut. Ihr Kind tritt einen Tag vor der Operation ein, wird durch unser Team der Pädiatrischen Neurochirurgie und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert. Anschliessend kommt es zur Überwachung auf die Intensivpflegestation (1. Stock).
Am Operationstag steht Ihnen eine Begleiterin vom Elternbegleitungsservice (BELOP) der Stiftung Pro UKBB zur Verfügung. Sie begleitet Sie, bis Ihr Kind eingeschlafen ist, und zeigt Ihnen, wo es wieder aufwachen wird. Zwischendurch hilft sie Ihnen, sich im Spital zurechtzufinden. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht (in der Regel am Folgetag), kommt es auf die kinderchirurgische Bettenstation (2. Stock).
In der Regel erholt sich Ihr Kind nach drei bis fünf Tagen von der Operation und darf auch in diesem Zeitraum nach Hause austreten. Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der Kinderneurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Prognose
Welche Prognose hat eine behandelte Kraniosynostose?
Die Prognose der behandelten Kraniosynostose ist in der Regel exzellent. Man kann bei Kindern mit einer sporadischen Kraniosynostose sehr gute kosmetische Resultate sowie eine normale Entwicklung und Lebensqualität erwarten. Tendenziell zeigen Kinder, die während des ersten Lebensjahrs operiert werden, eine bessere Entwicklung als Kinder, die zum Zeitpunkt der Operation älter sind. Die Entwicklung ist zudem davon abhängig, welche Form der Kraniosynostose vorliegt und welche begleitenden Probleme auftreten. Es kann vorkommen, dass eine zweite Operation notwendig wird, wenn sich die Nähte wieder verschliessen. Dies kommt in etwa 14 Prozent der Fälle vor und ist häufiger bei Kindern mit einer Kraniosynostose im Rahmen eines Syndroms.
Literatur
Weiterführende Literatur
DI Rocco, F., Licci, M., Paasche, A., Szathmari, A., Beuriat, P. A., & Mottolese, C. (2021). Fixed posterior cranial vault expansion technique. Child’s Nervous System : ChNS : Official Journal of the International Society for Pediatric Neurosurgery, 37(10), 3137–3141. https://doi.org/10.1007/s00381-021-05270-0
Frank, N., Beinemann, J., Thieringer, F. M., Benitez, B. K., Kunz, C., Guzman, R., & Soleman, J. (2021). The need for overcorrection: evaluation of computer-assisted, virtually planned, fronto-orbital advancement using postoperative 3D photography. Neurosurgical Focus, 50(4), E5. https://doi.org/10.3171/2021.1.FOCUS201026
Guzman, R., Looby, J. F., Schendel, S. A., & Edwards, M. S. B. (2011). Fronto-orbital advancement using an en bloc frontal bone craniectomy. Operative Neurosurgery (Hagerstown, Md.), 68(suppl_1), 68–74. https://doi.org/10.1227/NEU.0b013e31820780cd
Hayden Gephart, M. G., Woodard, J. I., Arrigo, R. T., Lorenz, H. P., Schendel, S. A., Edwards, M. S. B., & Guzman, R. (2013). Using bioabsorbable fixation systems in the treatment of pediatric skull deformities leads to good outcomes and low morbidity. Child’s Nervous System : ChNS : Official Journal of the International Society for Pediatric Neurosurgery, 29(2), 297–301. https://doi.org/10.1007/s00381-012-1938-y
Jaszczuk, P., Rogers, G. F., Guzman, R., & Proctor, M. R. (2016). X-linked hypophosphatemic rickets and sagittal craniosynostosis: three patients requiring operative cranial expansion: case series and literature review. Child’s Nervous System : ChNS : Official Journal of the International Society for Pediatric Neurosurgery, 32(5), 887–891. https://doi.org/10.1007/s00381-015-2934-9
Soleman, J., Thieringer, F., Beinemann, J., Kunz, C., & Guzman, R. (2015). Computer-assisted virtual planning and surgical template fabrication for frontoorbital advancement. Neurosurgical Focus, 38(5), E5. https://doi.org/10.3171/2015.3.FOCUS14852
Hydrocephalus (Wasserkopf)
Die wichtigsten Punkte
- Bei einem Hydrocephalus gibt es zu viel Hirnwasser im Schädel.
- Die häufigsten Ursachen sind: Frühgeburtlichkeit, angeborene Fehlbildung, Tumoren, Zysten und Gehirnblutungen.
- Typische Zeichen sind eine abnormale Kopfform, ein schnelles Kopfwachstum, eine vorstehende Fontanelle, Übelkeit, Erbrechen, Kopfschmerzen und Entwicklungsverzögerung.
- Die chirurgische Behandlung stellt den Abfluss des Hirnwassers wieder her.
- Die Prognose nach einer erfolgreichen Behandlung ist in der Regel sehr gut.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was ist ein Hydrocephalus?
Ein Hydrocephalus (auch Wasserkopf genannt) beschreibt ein Mehr an Hirnwasser (Liquor) im Schädel und betrifft ca. einen Fall pro 1000 Geburten. In unserem Gehirn wird täglich Liquor produziert und dort auch wiederaufgenommen. Bei einer Produktionsmenge entspricht ca. 20ml pro Stunde findet täglich ein viermaliger Gesamtaustausch des Liquors statt. Dieser Liquor dient als Pufferkissen zum Schutz unseres Gehirns. Der Liquor wird in den Ventrikeln produziert. Das sind vier Hohlräume in unserem Gehirn. Er fliesst durch diese vier Ventrikel und anschliessend um das Gehirn, bis er in der Hirnhaut wiederaufgenommen wird. Kommt es zu einer Verstopfung der Ventrikel oder seiner Abflüsse, zu einer vermehrten Produktion von Liquor (selten) oder zu einer verminderten Wiederaufnahme von Liquor, so entsteht ein Hydrocephalus.
Verschiedene Formen des Hydrocephalus
In der Kinderneurochirurgie unterscheiden wir zwischen:
- Obstruktiver Hydrocephalus: einem blockierten Abfluss des Liquors. Dies ist die häufigste Form des Hydrocephalus. Bei einer Blockade schwellen jeweils die Ventrikel an, die vor der Blockade im Abflusszyklus liegen.
- Malresorptiver Hydrocephalus: einer verminderten Wiederaufnahme des Liquors. Dabei schwellen typischerweise alle Ventrikel an.
- Hypersekretorischer Hydrocephalus: einer Überproduktion von Liquor. Diese Form ist sehr selten und tritt insbesondere bei einem Tumor des Plexus Choroideus (Organ, das Liquor produziert) auf. Auch hier sind oft alle vier Ventrikel angeschwollen.
All diese Formen können sowohl einzeln als auch kombiniert auftreten.
Mögliche Ursachen
Die Gründe für
einen Hydrocephalus können vielfältig sein. Man unterscheidet zwischen angeborenen und erworbenen Formen. Daher kann ein Hydrocephalus auch in jedem Alter
auftreten. Es gibt gewisse Risikofaktoren, die mit dem Auftreten eines
Hydrocephalus zusammenhängen können, aber nicht müssen – unter anderem ein
tiefes Geburtsgewicht, Frühgeburtlichkeit, männliches Geschlecht und
mütterlicher Diabetes mellitus («Zuckerkrankheit»).
- Angeborene Ursachen können unter anderem Entwicklungsstörungen des Gehirns sein (Chiari Malformation, Neuralrohdefekte), Infektionen des Kindes im Mutterleib (z.B. Mumps), erbliche Krankheiten oder Substanzen, die für die Kindsentwicklung im Mutterleib gefährlich sind («Teratogene»).
- Erworbene Ursachen können Hirnblutungen sein, Entzündungen des Gehirns, Zysten, Kopfverletzungen (Schädelhirntrauma) und Hirntumore.
Symptome
Was sind typische Anzeichen für einen Hydrocephalus?
Bei Föten und Säuglingen sind die Knochenverbindungen des Schädels (sogenannte Nähte) noch weich und verformbar. Staut sich viel Hirnwasser an, kann sich der Kopf unter dem Druck verformen. Es kommt in der Regel zu einer raschen Grössenzunahme des Kopfes (messbar mit dem Kopfumfang) und zu einer vollen und prallen Fontanelle.
Falls die Schädelknochen bereits geschlossen sind, findet vor allem ein Anstieg des Hirndrucks statt, da sich das Gehirn und die Ventrikel nicht weiter ausdehnen können. Ebenfalls von Bedeutung ist die Zeitspanne, in der ein Hydrocephalus entsteht.
Wenn in kurzer Zeit ein Hydrocephalus entsteht, kann sich das Gehirn dem steigenden Druck nicht schnell genug anpassen. Dann treten eher frühe und starke Symptome auf. Ein Hydrocephalus kann aber auch langsam entstehen, womit Symptome auch erst später auftreten.
Ansteigender Druck im Kopf führt typischerweise zu leichter Reizbarkeit, Kopfschmerzen, Übelkeit, Erbrechen, Gangstörungen oder neurologischen Ausfällen. Oft weisen Kinder auch eine Entwicklungsverzögerung auf und Entwicklungsmeilensteine werden nicht erreicht.
Diagnose
Wie wird ein Hydrocephalus diagnostiziert?
Klinische Verdachtsfälle werden in der Regel von pädiatrischen Neurolog*innen oder Entwicklungspädiater*innen untersucht. Zusätzlich lässt sich mittels einer Augenuntersuchung eine Schwellung des Augennervs, ein sogenanntes Papillenödem, feststellen, was für einen erhöhten Druck im Kopf sprechen würde.
Bleibt nach den Untersuchungen der Verdacht bestehen, wird als Nächstes eine Bildgebung des Schädels gemacht. Dabei handelt es sich bei Säuglingen (solange die Fontanelle offen ist) um einen Ultraschall. Falls sich dann die Verdachtsdiagnose im Ultraschall bestätigt wird eine Magnetresonanztomographie (MRT) zur Evaluierung der Ursache durchgeführt. Bei Kindern mit geschlossener Fontanelle wird direkt eine MRT durchgeführt.
Der Vorteil der Ultraschalldiagnostik ist, dass sie in wachem Zustand durchgeführt werden kann. Dies jedoch bei schlechterer Bildqualität als bei einer MRT. Für eine MRT wiederum müssen Säuglinge und Kinder bis zum Alter von ca. sieben bis neun Jahren in Narkose versetzt werden. Mit ihrer besseren Bildqualität bestätigt die MRT in der Regel auch die Ursache des Hydrocephalus.
Therapie
Was sind Behandlungsmöglichkeiten eines Hydrocephalus?
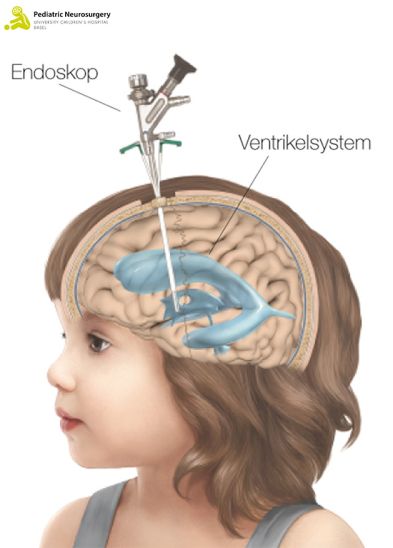
In den allermeisten Fällen ist eine Operation unumgänglich. Ein Hydrocephalus wird in der Regel nicht spontan besser. Die aktuellen Behandlungsmöglichkeiten für einen Hydrocephalus umfassen insbesondere zwei Kinderneurochirurgische Operationstechniken: ein sogenannter ventrikuloperitonealer Shunt oder eine sogenannte endoskopische Drittventrikulostomie.
Falls eine andere Krankheit zum Hydrocephalus führt (wie z.B. ein Tumor) muss diese ebenfalls behandelt werden. In der Folge bildet sich auch der Hydrocephalus in der Regel zurück.
Operation mit ventrikuloperitonealem Shunt (VPS)
Bei der Einlage eines ventrikuloperitonealen Shunts (VPS) wird ein kleines «Abflussröhrchen» (Shunt) zwischen dem Kopf und dem Bauchraum angelegt. Damit wird der Abfluss des Liquors wiederhergestellt.
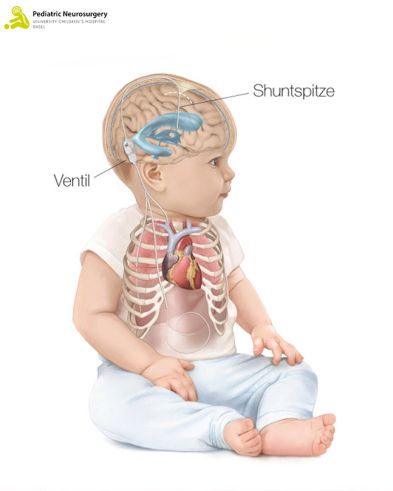
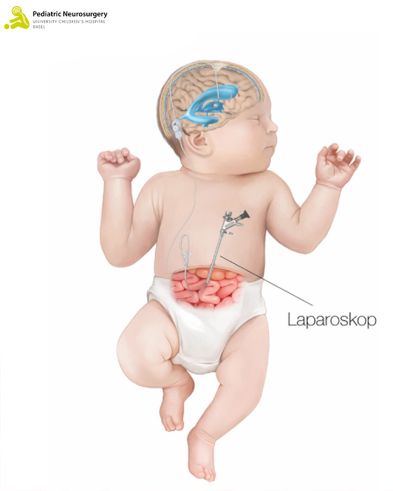
Die Einlage des VPS wird dabei wie folgt ausgeführt: Das Kind wird unter Narkose in Rückenlage positioniert. Nach minimaler Rasur der Haare wird ein ca. 2 cm grosser Hautschnitt vorne rechts am Kopf gemacht. Anschliessend wird ein kleines Loch in den Schädelknochen gebohrt. Mithilfe einer intraoperativen Bildgebung wird die Shuntspitze in den Ventrikel eingelegt. Anschliessend wird die Shuntspitze mit dem restlichen Shunt verbunden. Dieses «Abflussröhrchen» verläuft unter der Haut und ist mit einem Ventil verbunden. Das Ventil befindet sich ungefähr hinter dem Ohr und kann durch die Haut getastet werden (Abbildung 2). Am Ventil kann eine Druckhöhe eingestellt werden, ab welcher sich das Ventil öffnet und somit Liquor in den Bauchraum abfliessen kann. Dieser Prozess ist magnetisch regulierbar und kann von aussen mit einer Schablone verändert werden, sollte dies notwendig werden.
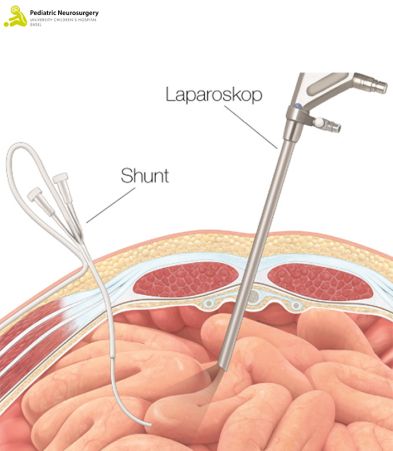
Das Ventil hinter dem Ohr wird mit einem zusätzlichen Schlauch verbunden, der unterhalb der Haut in Richtung des Bauchs verläuft. Am UKBB wird die Einlage des «Abflussröhrchens» gemeinsam mit Kinder-Bauchchirurg*innen durchgeführt. Diese nehmen den Schlauch auf Höhe des Bauchraums entgegen und bringen diesen mittels einer minimal invasiven (laparoskopischen) Methode unter Sichtkontrolle in den Bauchraum (Abbildung 3). Dafür sind zwei kleine Schnitte an der Bauchdecke und am Bauchnabel notwendig, die im Anschluss wieder vernäht und steril abgedeckt werden. Abschliessend werden die Schnitte am Bauch und am Kopf wieder zugenäht und steril abgedeckt. Die Operation dauert zwischen 30 und 60 Minuten.
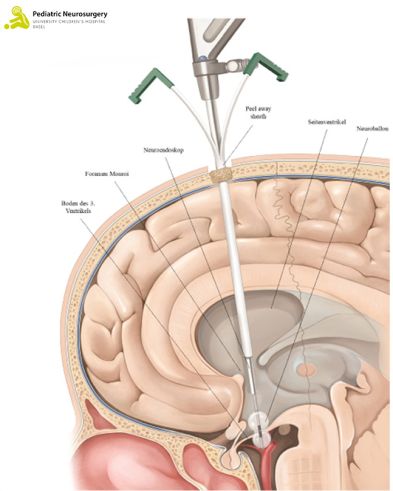
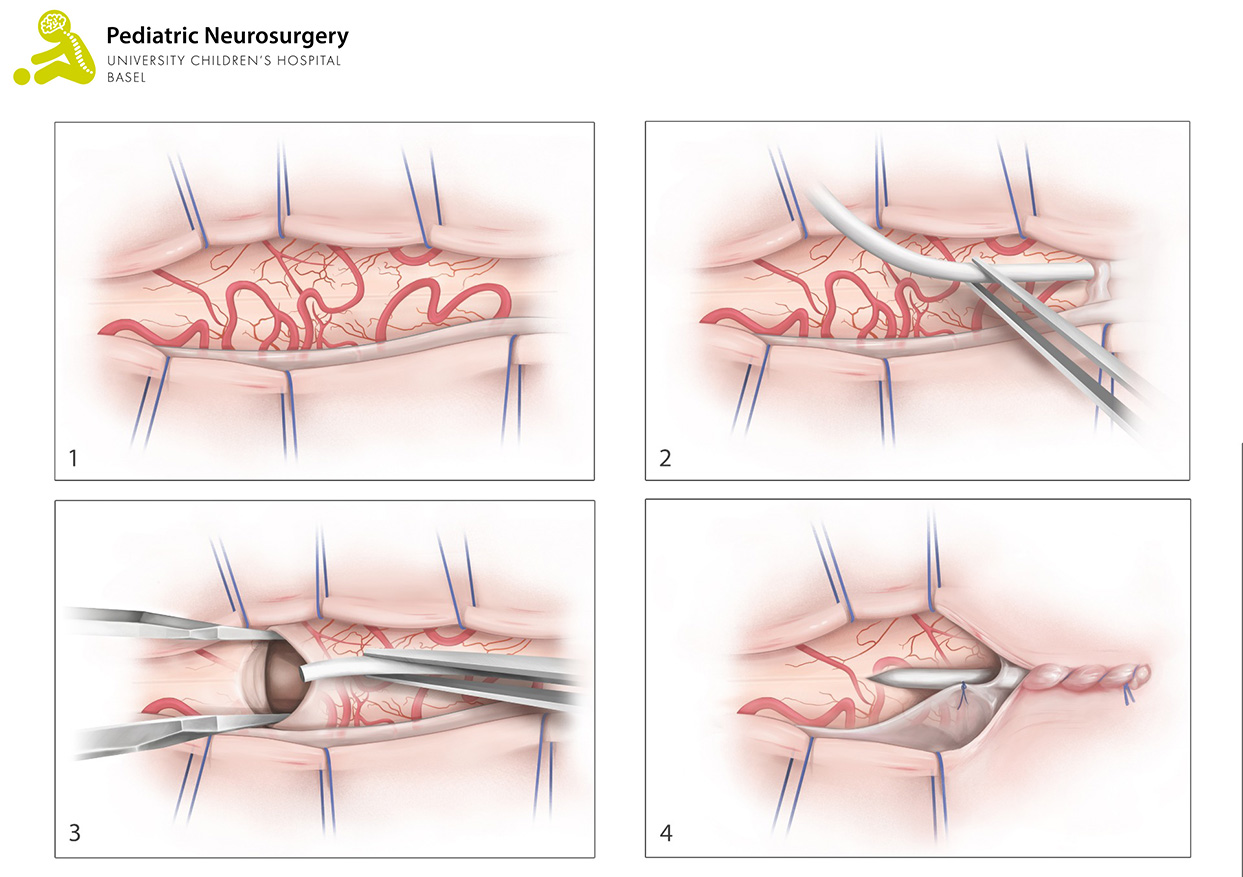
Alternativ kann in ausgewählten Fällen (vor allem bei obstruktivem Hydrocephalus) die endoskopische Drittventrikulostomie (ETV) erfolgen. Ebenfalls in Rückenlage und unter Narkose wird ein ca. 2 cm grosser Hautschnitt vorne rechts am Kopf gemacht und anschliessend ein kleines Loch in den Schädelknochen gebohrt. Durch dieses wird ein kameragesteuertes Endoskop (ein Metallstab mit Kamera und Lichtquelle am vorderen Ende) in die Ventrikel eingebracht (Abbildung 1). Anschliessend wird ein kleines Loch in den Boden des dritten Ventrikels gemacht, um den Abfluss des Liquors wiederherzustellen. Dieses Loch wird mittels eines kleinen Ballons gemacht, der einen neuen Abfluss (sogenannte Stomie) zwischen den Ventrikeln hergestellt. Anschliessend wird der Ventrikel wieder verlassen und der Zugangsschnitt verschlossen. Die Operation dauert zwischen 20 und 30 Minuten.
Vor- und Nachteile der Operationstechniken
Die beiden Operationstechniken sind sich ebenbürtig. Die ETV zeigt ein geringeres Risiko für Infekte verglichen mit dem VPS. Allerdings ist die Erfolgsrate der ETV bei Kindern unter einem halben Jahr im Vergleich zum VPS tiefer. Zusätzlich ist die ETV nicht für jede Form eines Hydrocephalus geeignet. Deshalb besprechen unsere erfahrenen Kinderneurochirurg*innen mit Ihnen, welche Methode die höchste Erfolgsrate im jeweiligen Fall aufweist und deshalb am geeignetsten ist für Ihr Kind.
Nach der Operation wird der Erfolg des Shunts oder der ETV mittels Bildgebung in den Nachkontrollen überprüft und die Feineinstellung des Ventils, falls notwendig, bei dem VPS gemacht.
Abbildung 3: Laparoskopische Einlage des unteren VPS-Anteils. Das obige Bild zeigt eine Übersicht, das untere Bild zeigt die Nahaufnahme der Technik.
Abbildung 2: Ventrikuloperitonealer Shunts (VPS) bei Kindern (oben) und Säuglingen (unten).
Abbildung 1: Eine endoskopische Drittventrikulostomie (VPS). Das obere Bild zeigt eine Übersicht, das untere Bild die Detailansicht.
Spitalaufenthalt
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie im UKBB betreut. Ihr Kind tritt einen Tag vor der Operation ein, wird durch unser Team und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wir Ihr Kind operiert. Anschliessend kommt es zur Überwachung in den Aufwachraum und nach ein paar Stunden wird es auf die Kinderchirurgische Bettenstation (Station B, 3. Stock) verlegt. Säuglinge jünger als sechs Monate werden nach der Operation bis zum Folgetag auf der Intensivstation überwacht (1. Stock).
Am Operationstag steht Ihnen eine Begleiterin vom Elternbegleitungsservice (BELOP) der Stiftung Pro UKBB zur Verfügung. Sie begleitet Sie, bis Ihr Kind eingeschlafen ist, und zeigt Ihnen, wo es wieder aufwachen wird. Zwischendurch hilft sie Ihnen, sich im Spital zurechtzufinden. Während der gesamten Zeit wird Ihr Kind von unserem Team der Pädiatrischen Neurochirurgie betreut.
Sobald Ihr Kind sich von der Operation erholt hat, darf es wieder nach Hause austreten. Während der gesamten Zeit dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der Pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Prognose
Welche Prognose hat ein behandelter Hydrocephalus?
Die Prognose für einen behandelten Hydrocephalus ist in der Regel sehr gut. Die Kinder zeigen häufig eine gute Entwicklung und haben eine gute Lebensqualität. Teilweise hängt die Prognose jedoch von der zugrundeliegenden Erkrankung und deren Begleiterscheinungen ab. Entsprechend kann die Prognose auch weniger gut ausfallen. Komplikationen nach einer ETV sind insgesamt selten (ca. 5 Prozent gesamthaft). Die häufigste Komplikation ist ein Wiederverschluss der durchgeführten Stomie oder aber ein bleibender Hydrocephalus trotz der Stomie. In diesen Fällen muss die ETV wiederholt oder ein VPS eingesetzt werden. Weitere seltene Risiken sind Infektionen, Blutungen, Krampfanfälle oder ein Schlaganfall.
Akute (kurzzeitige) Komplikationen nach einer VPS Implantation treten in ca. 3-5 Prozent der Fälle auf. Es handelt sich dabei vor allem um Infektionen (5-15 Prozent), Blutungen und Wundheilungsstörungen. In seltenen Fällen kann es zu einer sogenannten Überdrainage kommen. Das bedeutet, dass der Shunt zu viel Liquor abführt und es einen Zug auf das restliche Hirngewebe gibt. Dies kann zu Blutungen führen, welche einer Operation bedürfen. Die Langzeitkomplikationsrate (auf die gesamte Lebensdauer gesehen) ist beim VPS deutlich grösser. In ca. 20-30 Prozent der Fälle muss man damit rechnen, dass sich die Kinder mit VPS im Verlauf ihres Lebens einer sogenannte Shuntrevision (erneute Operation mit Ersetzen des Shunts oder Teile davon) unterziehen müssen, da es zu Brüchen, Verbindungsunterbrüchen (Dekonnektion), Verstopfung, Verschiebung und Infektionen im Shuntsystem kommen kann. In der Regel brauchen die Kinder den VPS lebenslang. Ein VPS kann im Verlauf des Lebens nur selten wieder gänzlich entfernt werden.
Literatur
Weiterführende Literatur
Stoessel T, Guzman R, Soleman J. Die Behandlung des Hydrocephalus bei Kindern. Swiss Med forum. 2021;2021/39-40:664-669.
Bartoli A, Soleman J, Berger A, et al. Treatment Options for Hydrocephalus Following Foramen Magnum Decompression for Chiari I Malformation: A Multicenter Study. Neurosurgery. 2020;86(4):500-508. doi:10.1093/neuros/nyz211
Roth J, Soleman J, Kozyrev DA, et al. The value of cerebrospinal fluid lactate levels in diagnosing CSF infections in pediatric neurosurgical patients. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2019;35(7):1147-1153. doi:10.1007/s00381-019-04163-7
Roth J, Soleman J, Kozyrev DA, et al. Value of Cerebrospinal Fluid Lactate Levels in Diagnosing Shunt Infections in Pediatric Patients. World Neurosurg. 2019;129:e207-e215. doi:10.1016/j.wneu.2019.05.111
Licci M, Zaed I, Beuriat P-A, et al. CSF shunting in myelomeningocele-related hydrocephalus and the role of prenatal imaging. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2021;37(11):3417-3428. doi:10.1007/s00381-021-05217-5
Soleman J, Schneider CA, Pfeifle VA, Zimmermann P, Guzman R. Laparoscopic-Assisted Ventriculoperitoneal Shunt Placement in Children Younger Than the Age of 1 Year. World Neurosurg. 2017;99:656-661. doi:https://doi.org/10.1016/j.wneu.2016.12.075
Serafimova M, Soleman J, Stoessel T, Guzman R, Constantini S, Roth J. Peritoneal insertion of shunts in children: comparison between trocar and laparoscopically guided insertion. Child’s Nerv Syst. 2021;37(1):115-123. doi:10.1007/s00381-020-04760-x
Choudhri O, Feroze AH, Nathan J, Cheshier S, Guzman R. Ventricular endoscopy in the pediatric population: review of indications. Child’s Nerv Syst. 2014;30(10):1625-1643. doi:10.1007/s00381-014-2502-8
Soleman J, Guzman R. Neurocognitive Complications after Ventricular Neuroendoscopy: A Systematic Review. Behav Neurol. 2020;2020:2536319. doi:10.1155/2020/2536319
Licci M, Thieringer FM, Guzman R, Soleman J. Development and validation of a synthetic 3D-printed simulator for training in neuroendoscopic ventricular lesion removal. Neurosurg Focus. 2020;48(3):E18. doi:10.3171/2019.12.FOCUS19841
Soleman J, Kozyrev DA, Constantini S, Roth J. Surgical treatment and outcome of posterior fossa arachnoid cysts in infants. J Neurosurg Pediatr. 2021;28(5):544-552. doi:10.3171/2021.5.PEDS21119
Soleman J, Benvenisti H, Constantini S, Roth J. Conversion of external ventricular drainage to ventriculo-peritoneal shunt: to change or not to change the proximal catheter? Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2017;33(11):1947-1952. doi:10.1007/s00381-017-3544-5
Kindliche Hirntumoren
Die wichtigsten Punkte
- Tumoren der hinteren Schädelgrube bzw. Hirntumoren treten bei Kindern selten auf. Die häufigsten Hirntumorarten sind dabei pilozytische Astrozytome, Medulloblastome und Ependymome.
- Die Symptome von Hirntumoren sind sehr verschieden und oft unspezifisch. Typisch sind Anzeichen, die auf einen erhöhten Hirndruck oder neurologische Ausfälle hinweisen. Bei Säuglingen bildet sich oftmals ein Wasserkopf.
- Hirntumoren werden in erster Linie durch eine möglichst vollständige chirurgische Entfernung behandelt. Zum Teil ist zusätzlich eine Chemotherapie oder eine sogenannt gezielte Therapie («targeted therapy») notwendig.
- Die Prognose bei Hirntumoren hängt stark von der Tumorart und seiner Lage ab. Vollständig entfernte pilozytische Astrozytome haben dabei in der Regel eine exzellente Prognose, bei Medulloblastomen und Ependymomen können die Prognosen ausgezeichnet, gut oder auch weniger gut sein.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was sind Tumoren der hinteren Schädelgrube?
Hirntumoren kommen im Kindesalter zwar selten vor, sind aber trotzdem die zweithäufigste Tumorart (nach Leukämien) und die häufigste Form von soliden Tumoren bei Kindern. Kindliche Hirntumoren kommen mehrheitlich in der hinteren Schädelgrube vor (hinterer Bereich des Schädels). Hierbei sind die häufigsten Tumorarten das pilozytische Astrozytom, das Ependymom und das Medulloblastom.
Pilozytisches Astrozytom
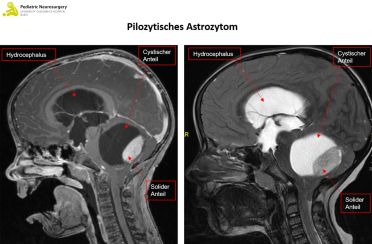
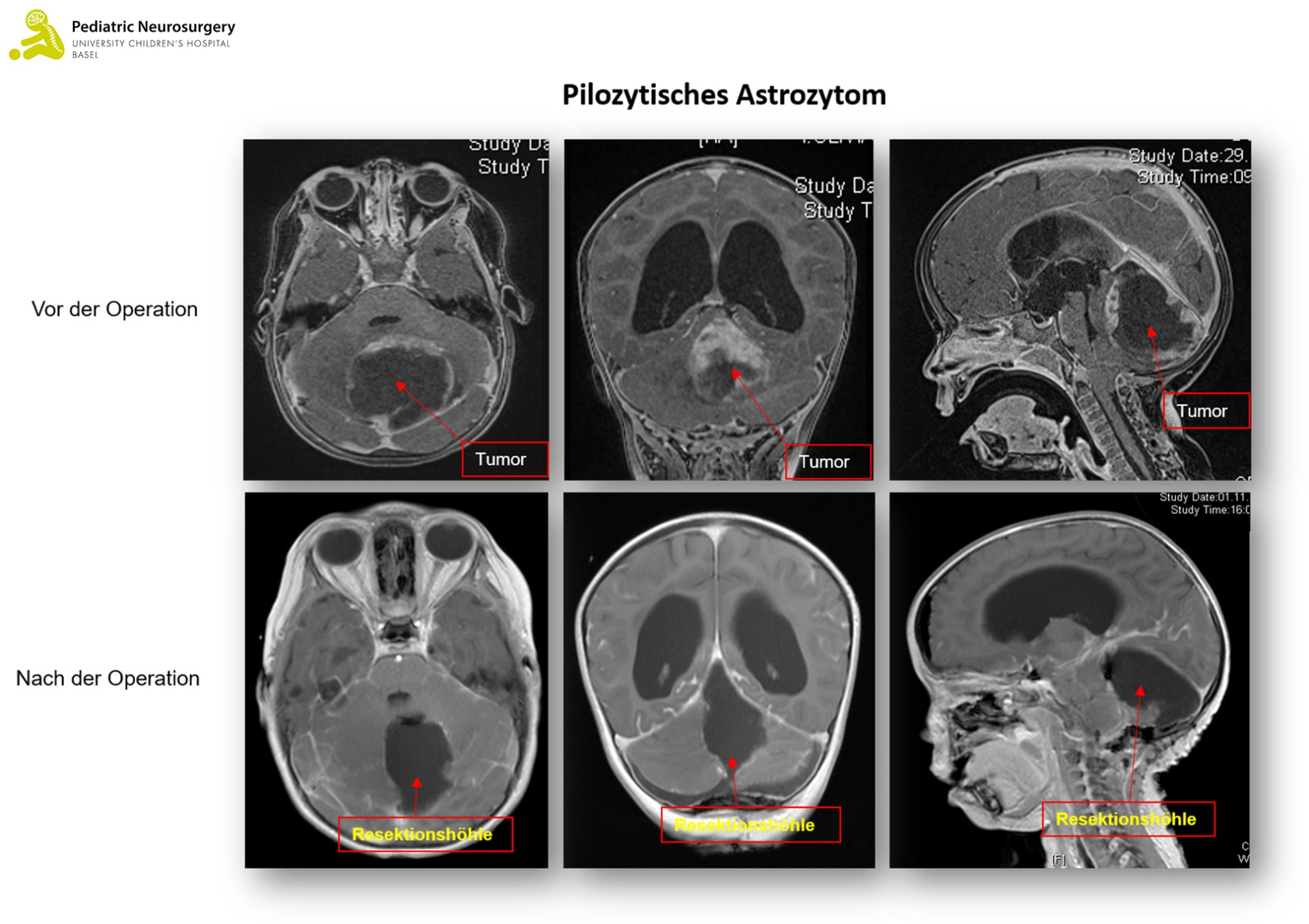
Das pilozytische Astrozytom ist der häufigste Hirntumor bei Kindern (17 Prozent aller Kinderhirntumore) Er tritt bei etwa 1 auf 100'000 Kindern pro Jahr auf, meistens zwischen dem fünften und achten Lebensjahr, und gehört gemäss Klassifikation der Weltgesundheitsorganisation (WHO) zu den «niedriggradigen» und somit gutartigen Tumoren (WHO-Grad I).
Prinzipiell kann das Astrozytom in allen Bereichen des Gehirns vorkommen. Klassischerweise tritt es bei Kindern jedoch im Bereich des Hirnstamms oder Kleinhirns auf, in seltenen Fällen im Rückenmark. Das pilozytische Astrozytom kann verschiedene genetische Subgruppen haben. In 70 Prozent der Fälle ist eine Veränderung (Mutation) im BRAF und KIAA1549 Gen anzutreffen. Diese Mutationen führen über verschiedene Signalwege der Tumorzellen dazu, dass zum Beispiel das Wachstum oder die «Unsterblichkeit» der Zelle gefördert wird. Das pilozytische Astrozytom tritt vermehrt (in 15 Prozent der Fälle) mit einer sogenannten Neurofibromatose Typ I (Von Recklinghausen Krankheit) auf.
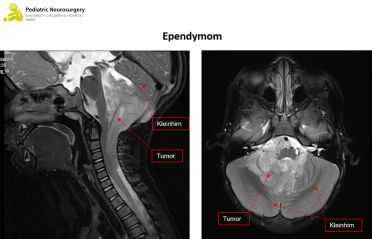
Ependymom
Ependymome betreffen etwa 0.3 pro 100'000 Personen und Jahr. Sie kommen vor allem im Bereich der hinteren Schädelgrube in direkter Nachbarschaft zu den Gehirnwasserkammern (Ventrikel) vor. Prinzipiell können sie aber auch in allen anderen Bereichen des Gehirns und Rückenmarks vorkommen. Bei Kindern sind jedoch 80 Prozent der Ependymome in der hinteren Schädelgrube zu finden, bei Erwachsenen hingegen eher im Rückenmark. Man klassifiziert Ependymome als «klassische Ependymome» (WHO Grad II) und «anaplastische Ependymome» (WHO Grad III). Es handelt sich damit um «höhergradige» Tumoren. Meistens treten sie im frühen Kindesalter zwischen zwei und fünf Jahren auf ,können aber theoretisch bis zu einem Alter von 40 Jahren auftreten. Man unterscheidet in der hinteren Schädelgrube grob zwischen Gruppe A Ependymomen (neu auch PF-EPN-A («Posterior fossa ependymoma A»), vor allem bei jüngeren Kindern) und Gruppe B Ependymomen (neu PF-EPN-B («Posterior fossa ependymoma B»), vor allem bei älteren Kindern), wobei Gruppe A häufig eine schlechtere und Gruppe B eher eine bessere Prognose hat. Ein gehäuftes Auftreten im Rahmen von familiären Syndromen ist bei dem Ependymom nicht zu beobachten.
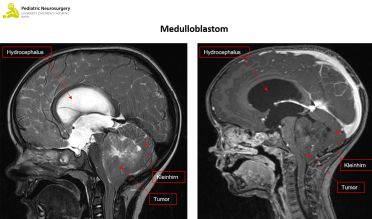
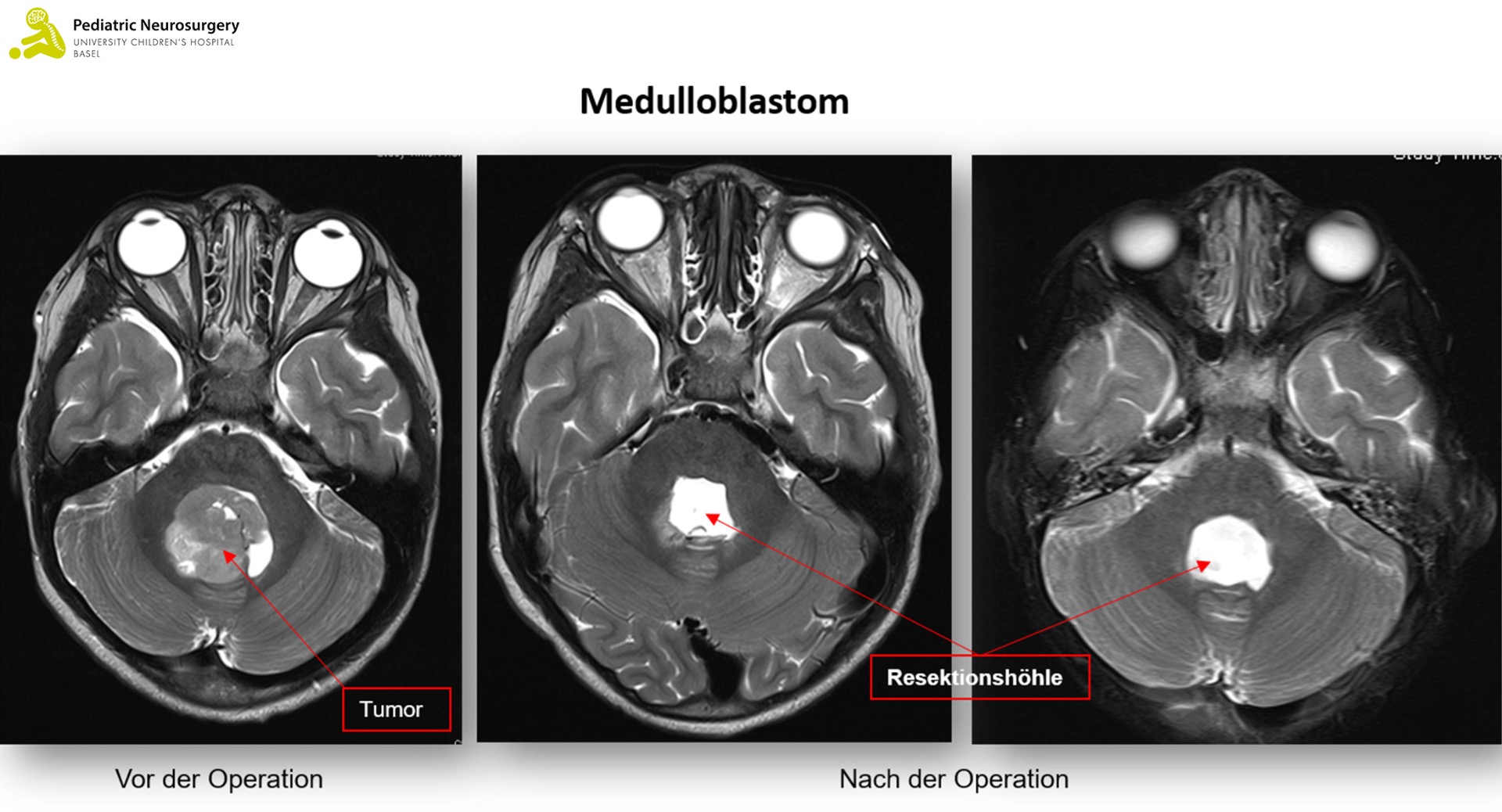
Medulloblastom
Das Medulloblastom ist der häufigste hochgradige Hirntumor bei Kindern und macht ca. 10 Prozent aller Hirntumoren aus. Meistens tritt ein Medulloblastom zwischen dem fünften und zehnten Lebensjahr im Bereich des Kleinhirns oder der vierten Hirnkammer (Ventrikel) auf. Hier unterscheidet man vier Subgruppen, die entsprechend dem Vorhandensein von Veränderungen in Genen für Zellsignalwege eingeteilt sind (sogenannte molekulare Subtypen). Das sind der Wingless-Typ (WNT-Typ), der Sonic hedge hog-Typ (SHH, weiter eingeteilt in p53-Wildtyp und p53-mutiert (selten)) und dann Subgruppen, die weder SHH noch WNT verändert sind nämlich non-WNT/non-SHH group 3 und non-WNT/non-SHH group 4. Diese Untergruppen des Medulloblastoms haben unterschiedliche Verläufe und unterschiedliche Prognosen, wobei der WNT-Typ eher eine bessere, der SHH-Typ mit p53 mutiert eine schlechte, der SHH-Typ mit Wildtyp p53 eine gute und Gruppe 3 und 4 eine mittlere bis schlechte Prognose haben. Medulloblastome können im Rahmen von familiären Syndromen auftreten (z.B. Gorlin Syndrom, Familiäre adenomatöse Polyposis oder das Li-Fraumeni Syndrom), entstehen aber meist spontan.
Symptome
Was sind typische Zeichen von Tumoren der hinteren Schädelgrube?
Hirntumoren können sich verschiedenartig äussern. Allen gemeinsam sind Anzeichen, die auf einen erhöhten Hirndruck hindeuten wie Kopfschmerzen, Übelkeit und Erbrechen. Weitere Zeichen sind neurologische Ausfälle, die sich insbesondere in Form von Gangstörungen bemerkbar machen sowie Störungen der Feinmotorik (zunehmende «Ungeschicklichkeit»), Doppeltsehen, Schielen, Störungen der Augenbewegungen und Störungen der Sprache und/oder des Sprachverständnis.
Bei Säuglingen kann sich ein Hirntumor durch rasches oder unnatürliches Kopfwachstum, eine gespannte und pralle Fontanelle durch einen Wasserkopf, Entwicklungsverzögerungen und leichte Reizbarkeit präsentieren. In seltenen Fällen können Hirntumoren epileptische Anfälle verursachen.
Leider sind die meisten Symptome eines Hirntumors eher unspezifisch. So kann zum Beispiel Erbrechen aufgrund eines Hirntumors leicht als Zeichen einer Magen-Darm-Grippe fehlinterpretiert werden. So vergeht meistens 6 bis 12 Monate, bis die auftretenden Symptome korrekt mit einem vorhandenen Hirntumor in Zusammenhang gebracht werden können.
Diagnose
Wie werden Tumoren der hinteren Schädelgrube diagnostiziert?
Der Verdacht auf einen Hirntumor wird mit einer Bildgebung des Kopfes (und der Wirbelsäule) in Form einer Magnetresonanztomographie (MRT) erhärtet. Das pilozytische Astrozytom zeigt sich meist scharf abgegrenzt, das heisst es gibt keine Invasion des übrigen Hirngewebes. Das Gleiche gilt auf für das Ependymom, wobei dieser oft um die sogenannten Hirnnerven wächst, was eine operative Entfernung erschwert. Das Medulloblastom wächst typischerweise innerhalb oder in der Nähe der vierten Hirnkammer (Ventrikel). Zur genauen Diagnose braucht es allerdings eine Gewebsanalyse des Tumors.
Das Gewebe zur Gewebsanalyse wird bei der Operation gewonnen. Unsere Neuropathologie, die schweizweit das Referenzzentrum für kindliche Hirntumoren ist, analysiert das Gewebe anschliessend genauestens. Im Falle eines Ependymoms oder Medulloblastoms kann es notwendig sein, dass Hirnwasser mit einer sogenannten Lumbalpunktion gewonnen und untersucht werden muss, um eine Aussaat des Tumors auszuschliessen.
Therapie
Wie lassen sich Tumoren der hinteren Schädelgrube behandeln?
Gehirntumoren lassen sich in erster Linie durch eine chirurgische Entfernung behandeln (Resektion). Die Therapie kann aber auch aus einer Kombination von Operation, Strahlentherapie und Chemotherapie bestehen.
Mögliche Therapien nach Tumorart
Beim pilozytischen Astrozytom ist die chirurgische Resektion die Therapie der Wahl. Eine Chemo- oder Strahlentherapie wird nur dann notwendig, wenn die Resektion nur unvollständig war und der Tumor weiterwächst – oder wenn der Tumor zum Beispiel aufgrund seiner Nähe zu lebenswichtigen Gehirnstrukturen unmöglich chirurgisch entfernt werden kann. Heutzutage lassen sich auch solche Tumoren im Rahmen der Chemotherapie mit einer gezielten Therapie (sogenannte «Targeted Therapy») behandeln, sofern der Tumor gewisse genetische Merkmale aufweist.
Im Falle des Ependymoms ist ebenfalls eine komplette Entfernung des Tumors notwendig. Nach der Operation (und falls keine oder nur eine limitierte Resektion möglich ist), wird eine Strahlentherapie eingeleitet. Diese Tumoren reagieren sehr schlecht auf eine Chemotherapie, weshalb sie nur selten angewandt wird.
Die primäre Therapie eines Medulloblastoms ist die komplette chirurgische Entfernung des Tumors. Falls dies aufgrund der engen Nachbarschaft zum Kleinhirn, dem Hirnstamm und dem Gehirnwassersystem nicht oder nur bedingt möglich ist, wird nach der Operation eine Bestrahlung des Tumorgebiets, eines allfälligen Resttumors sowie des gesamten Rückenmarks durchgeführt. Zusätzlich dazu wird das Behandlungsschema mit einer Chemotherapie ergänzt. Die Nachbehandlung mittels Chemo- oder Bestrahlungstherapie ist beim Medulloblastom stark vom molekularen Subtyp abhängig. Der Einsatz von «Targeted Therapies» für die Subtypen des Medulloblastoms ist ein Gebiet, das aktuell erforscht wird.
Chirurgische Techniken
Die chirurgische Technik ist bei all diesen Tumoren sehr ähnlich. Die Kinder werden unter Narkose in Bauchlage positioniert. Der klassische Zugang zum Tumor der hinteren Schädelgrube ist der sogenannte suboccipitale Zugang. Dabei wird ein Hautschnitt mittig am Hinterkopf und im Nackenbereich gemacht, die Muskeln werden vorsichtig abgelöst, zwei kleine Löcher werden in den Knochen gebohrt, welche anschliessend zu einer sogenannten Kraniotomie (Eröffnung der Schädelkalotte) erweitert werden. Danach werden die Hirnhäute eröffnet und der Tumor dargestellt. Anschliessend wird der Tumor mit Hilfe eines Ultraschall-Zertrümmerers und weitere Mikroinstrumente vorsichtig unter dem Operationsmikroskop entfernt. Danach wird die Schädelplatte wiedereingesetzt, mit selbstauflösenden Platten fixiert und die Haut mittels selbstauflösender Fäden verschlossen.
Da teilweise ein Hydrocephalus (sogenannter Wasserkopf) mit einem Tumor der hinteren Schädelgrube einhergeht, muss dieser ebenfalls behandelt werden. Während der Operation wird in diesen Fällen ein Schlauch in die Hirnkammern eingelegt, um das Hirnwasser nach aussen in einen Kanister abzuleiten (sogenannte Extraventrikuläre Drainage). Die Operation dauert im Durchschnitt 3 bis 5 Stunden.
Operationsrisiken
Mögliche Komplikationen nach diesen Operationen sind eine Pseudomeningocele (Ansammlung von Hirnwasser unter der Haut), Liquorfistel (Austritt von Hirnwasser aus der Wunde), Nachblutungen, Infektionen, Schäden an den umliegenden Hirnstrukturen. In ca. 30 Prozent der Fälle kann trotz erfolgreicher Tumorentfernung und eingelegter externen Ventrikel Drainage weiterhin eine Zirkulationsstörung des Hirnwassers bestehen. Gegebenenfalls benötigen die Kinder eine zusätzliche Operation, damit später über ein Abflussröhren (ventrikulo-peritonealen Shunt) angesammelte Hirnflüssigkeit in den Bauchraum abgeleitet werden kann. Weitere Informationen dazu finden Sie auf unserem Abschnitt zur Behandlung des Hydrocephalus.
Unser erfahrenes Team der pädiatrischen Neurochirurgie berät Sie in Zusammenarbeit mit den Kolleg*innen der Kinderonkologie, um für Ihr Kind die optimale Therapie zu bestimmen.
Spitalaufenthalt
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie am UKBB betreut. Falls Ihr Kind nicht notfallmässig über die Notfallstation eingetreten ist, wird es einen Tag vor der Operation eintreten und nochmals durch unser Team der pädiatrischen Neurochirurgie und die Narkoseärzte (Anästhesie) untersucht. Falls Sie dies wünschen, kann Ihr Kind danach noch einmal zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Kinder-Intensivpflegestation (1. Stock).
Sollte Ihr Kind notfallmässig eingetreten und in einem wachen Zustand sein, wird es über die Nacht auf unserer Kinder-Intensivstation engmaschig überwacht und die Operation am Folgetag durchgeführt. Eine sofortige Notoperation ist sehr selten notwendig.
Am Operationstag steht Ihnen eine Begleiterin vom Elternbegleitungsservice (BELOP) der Stiftung Pro UKBB zur Verfügung. Sie begleitet Sie, bis Ihr Kind eingeschlafen ist, und zeigt Ihnen, wo es wieder aufwachen wird. Zwischendurch hilft sie Ihnen, sich im Spital zurechtzufinden. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht, kommt es auf die kinderchirurgische Bettenstation (2. Stock, Station B).
In der Regel erholt sich Ihr Kind nach fünf bis sieben Tagen von der Operation und darf auch in diesem Zeitraum nach Hause austreten. In gewissen Fällen wird Ihr Kind eine Neurorehabilitation brauchen- Diese wird durch unser Team evaluiert und falls notwendig auch organisiert. Anschliessend wird die weitere Behandlung weitergeführt, wie sie im Rahmen eines Kinder-Tumor-Boards mit den verschiedenen Fachdisziplinen festgelegt wurde. Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Prognose
Welche Prognose hat eine behandelte Kraniosynostose?
Die Prognose der Gehirntumoren ist abhängig von der Art des Tumors, der Lage, der Ausbreitung bei Diagnosestellung und des Resektionsausmasses des Tumors.
Pilozytisches Astrozytom
Das pilozytische Astrozytom hat bei vollständiger Entfernung eine ausgezeichnete Prognose. Der Tumor selbst ist niedriggradig, das heisst er wächst langsam und ohne das Gewebe zu infiltrieren. Darum kann er meist komplett entfernt und somit geheilt werden. Ebenfalls streut der Tumor nur sehr selten. Allerdings können je nach Lage des Tumors Gehirnstrukturen beeinträchtigt oder zerstört worden sein, sei es durch den Tumor selbst oder durch die Entfernung. Dies kann zu kognitiven Einschränkungen und/oder bleibenden neurologischen Schäden führen.
Ependymom
Die Prognose des Ependymoms ist je nach Typ unterschiedlich. Eine grosse Rolle spielt, wo der Tumor gelegen ist und wie viel davon entfernt werden konnte. Bei kompletter Entfernung beträgt das Langzeitüberleben nach zehn Jahren etwa 50-70 Prozent. Ebenfalls wichtig ist das Alter der Kinder bei Auftreten des Tumors, die Subgruppe des Tumors und die Gradierung des Tumors. Wegen der Lage in unmittelbarer Nachbarschaft des Kleinhirns und vieler wichtiger Hirnnerven besteht ein erhöhtes Risiko für Kleinhirn- oder Hirnnervenschäden. Weiterhin können Begleiterscheinungen als Folge der Chemo- und Radiotherapie wie z.B. Wachstumsprobleme und Gedächtnisstörungen auftreten.
Medulloblastom
Die Prognose des Medulloblastoms mit den heutigen Therapieansätzen ist gut, etwa 70 Prozent der Kinder überleben bis ins Erwachsenalter. Die Prognose ist stark von dem Grad der Entfernung, dem Alter bei Auftreten, einer eventuellen Streuung des Tumors und der molekularen Subgruppe abhängig. Der WNT-Typ hat eine ausgezeichnete Prognose, der SHH p53 nicht mutierte Typ eine gute (bis zu 75 Prozent Überleben), der SHH p53-mutierte Typ eine eher schlechte, und Gruppe 3 und 4 ebenfalls eine eher schlechte Prognose. Insbesondere Tumoren der Gruppe 3 haben in 30 Prozent der Fälle bei Entdeckung bereits Ableger gebildet. Das Medulloblastom hat eine Rückkehrrate von ca. 20 bis 30 Prozent, was oft mit einer schlechten Prognose verbunden ist. Leider kann die kombinierte Therapie eines Medulloblastoms wie auch bei dem Ependymom weitere Begleiterscheinungen zur Folge haben (z.B. Wachstumsstörungen, Hirnnervenstörungen, Hörverlust, kognitive Einschränkungen).
Literatur
Weiterführende Literatur
Franceschi E, Hofer S, Brandes AA, Guzman R et al. EANO-EURACAN clinical practice guideline for diagnosis, treatment, and follow-up of post-pubertal and adult patients with medulloblastoma. Lancet Oncol. 2019;20(12):e715-e728. doi:10.1016/S1470-2045(19)30669-2
Hayden Gephart MG, Colglazier E, Paulk KL, Vogel H, Guzman R, Edwards MSB. Primary pediatric skull tumors. Pediatr Neurosurg. 2011;47(3):198-203. doi:10.1159/000330544
Gephart MGH, Taft BP, Giese A-K, Guzman R, Edwards MSB. Perioperative posterior reversible encephalopathy syndrome in 2 pediatric neurosurgery patients with brainstem ependymoma. J Neurosurg Pediatr. 2011;7(3):235-237. doi:10.3171/2010.12.PEDS10299
Greuter L, Guzman R, Soleman J. Typical Pediatric Brain Tumors Occurring in Adults-Differences in Management and Outcome. Biomedicines. 2021;9(4). doi:10.3390/biomedicines9040356
Soleman J, Kozyrev DA, Ben-Sira L, Constantini S, Roth J. Management of incidental brain tumors in children: a systematic review. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2020;36(8):1607-1619. doi:10.1007/s00381-020-04658-8
Soleman J, Dvir R, Ben-Sira L, et al. MRI-based diagnosis and treatment of pediatric brain tumors: is tissue sample always needed? Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2021;37(5):1449-1459. doi:10.1007/s00381-021-05148-1
Soleman J, Roth J, Ram Z, Yalon M, Constantini S. Malignant transformation of a conservatively managed incidental childhood cerebral mass lesion: controversy regarding management paradigm. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2017;33(12):2169-2175. doi:10.1007/s00381-017-3566-z
Roth J, Soleman J, Paraskevopoulos D, Keating RF, Constantini S. Incidental brain tumors in children: an international neurosurgical, oncological survey. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2018;34(7):1325-1333. doi:10.1007/s00381-018-3836-4
Greuter L, Guzman R, Soleman J. Pediatric and Adult Low-Grade Gliomas: Where Do the Differences Lie? Child (Basel, Switzerland). 2021;8(11). doi:10.3390/children8111075
Ebel F, Greuter L, Guzman R, Soleman J. Transitional Care in Pediatric Brain Tumor Patients: A Systematic Literature Review. Child (Basel, Switzerland). 2022;9(4). doi:10.3390/children9040501
Ebel F, Greuter L, Licci M, Guzman R, Soleman J. Endoscopic and Endoscopically-Assisted Resection of Intraventricular Lesions Using a Neuroendoscopic Ultrasonic Aspirator. J Clin Med. 2021;10(17). doi:10.3390/jcm10173889
https://www.mdpi.com/journal/children/special_issues/Brain_Tumors_Children
Plexus Tumore im Kindesalter
Die wichtigsten Punkte
- Plexus-Tumore sind selten und können entweder gutartig (Plexus Papillome) oder bösartig (Plexus Karzinom) sein
- Plexus Tumoren präsentieren sich häufig durch Zeichen eines Hydrozephalus (Wasserkopf)
- Bei Plexus Papillomen ist die Operation meistens heilend
- Bei Plexus Karzinomen ist die Operation zusammen mit Strahlen- und Chemotherapie die Therapie der Wahl
- Die Prognose bei Plexus Papillomen ist günstig, bei Plexus Karzinomen eher ungünstig
Diagnose, Behandlung und Prognosen
Krankheitsbild
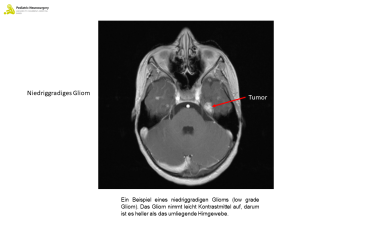
Was sind Plexus-Tumore, niedriggradige Gliome und hochgradige Gliome?
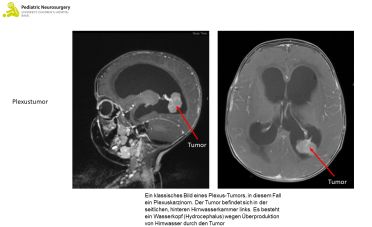
Die Plexus Tumore entstehen aus und am sogenannten Plexus choroideus. Der Plexus choroideus ist eine Struktur in den vier Hirnwasserkammern (sogenannte Ventrikel), der das Hirnwasser produziert. Plexus-Tumore sind extrem selten, sie machen weniger als ein Prozent aller Hirntumore, bei Kindern jedoch ca. 10-15%, aus. Die meisten Plexus-Tumore treten in den Seitenventrikeln, also den beiden grössten Hirnwasserkammern, auf, während ca. 40% der restlichen Plexus-Tumore im vierten Ventrikel und ca. 5% im dritten Ventrikel vorkommen. Man teilt die Plexus-Tumore in zwei Kategorien ein, die Plexus Papillome und die Plexus Karzinome. Plexus Papillome sind in der Regel niedriggradige Tumore und machen den grösseren Anteil der Plexus-Tumore aus (ca. 60%). Man weiss nicht genau, wie Plexus Papillomen entstehen, man geht aktuell davon aus, dass es sich um ein überschiessendes Wachstum des Plexus choroideus handelt. Plexus Karzinome sind hochgradige Tumore des Plexus choroideus. Bei ihrer Entstehung spielen Mutationen in Zellwachstumsstoppern eine wichtige Rolle. Plexus Tumore führen häufig zu einer Überproduktion von Hirnwasser und sind deshalb oft mit einem Wasserkopf (siehe Factsheet «Hydrocephalus») assoziiert.
Symptome
Was sind typische Zeichen von Plexus-Tumoren?
Plexus Tumoren können sich mit verschiedenen Zeichen äussern. Da diese Tumore vermehrt Hirnwasser produzieren kommt es häufig zu einem sogenannten Wasserkopf (siehe Factsheet «Hydrocephalus»), was zu Symptomen eines erhöhten Hirndrucks (Kopfschmerzen, Übelkeit und Erbrechen) führt. Bei Säuglingen kann der Hydrocephalus zu ein rasches oder unnatürliches Kopfwachstum, eine gespannte und pralle Fontanelle, Entwicklungsverzögerungen oder leichte Reizbarkeit führen. Weiter können neurologische Ausfälle vorkommen, insbesondere Gangstörungen, Störungen der Feinmotorik (zunehmende «Ungeschicklichkeit»), Doppeltsehen, Schielen, Störungen der Augenbewegungen und Störungen der Sprache und/oder des Sprachverständnis. In seltenen Fällen können Hirntumore epileptische Anfälle verursachen.
Leider sind die meisten Symptome eines Hirntumors eher unspezifisch (z.B. Erbrechen, was oft als eine Magen-Darm-Grippe fehlinterpretiert werden kann), was das korrekte Erkennen eines Tumors oft verzögert. Meist vergehen 6-12 Monaten bevor die Symptome korrekt mit dem Tumor in Verbindung gebracht wird.
Diagnose
Wie werden Plexus-Tumore diagnostiziert?
Der Verdacht auf einen Plexus Tumor wird meist mit einer Bildgebung des Kopfes in Form einer Magnet Resonanz Tomographie (MRT) bestätigt.
Die Tumorart kann aber im MRT nicht sicher bestimmt werden, weshalb es in der Regel eine Operation (entweder Entfernung oder die Entnahme einer Gewebeprobe) braucht.
Alle Kinder mit Hirntumoren bekommen zusätzlich ein MRT der gesamten spinalen Achse (MRT des Rückens) um sogenannte Abtropf-Metastasen im Bereich des Rückenmarks auszuschliessen.
Die Gewebsanalyse des Tumors wird genauestens durch unsere Neuropathologie, das schweizweite Referenzzentrum für kindliche Hirntumoren, analysiert.
Prognose
Was sind Behandlungsmöglichkeiten bei Plexus-Tumoren?
Die Therapie der Gehirntumoren ist in erster Linie die chirurgische Entfernung des Tumors, kann aber auch aus einer Kombination von Operation, Strahlentherapie und Chemotherapie, oder nur aus einer Chemotherapie und/oder Bestrahlung bestehen.
Plexus-Tumore werden meist operativ behandelt, wobei Plexus Papillome danach in der Regel keine weitere Behandlung brauchen, während bei Plexus Karzinome die Behandlung mit Bestrahlungs- und Chemotherapie ergänzt werden kann.
Die Operation ist minimalinvasiv und kann entweder mittels Mikroskops oder Endoskop durchgeführt werden. Die endoskopische Operation ist bei kleineren, nicht stark durchbluteten Tumoren möglich, dabei wird mittels eines Bohrers ein kleines Loch in den Schädelknochen gebohrt. Durch dieses Loch wird mit einer Kamera (ein sogenanntes Endoskop) das Ventrikel System aufgesucht. Im Ventrikel System wird dann der Plexus-Tumor identifiziert und entfernt. Der Neurochirurg sieht dabei die Operation durch die Kamera am Endoskop. Anschliessend wir das Loch im Schädelknochen wieder verschlossen und die Muskulatur und die Haut werden wieder zugenäht. Bei der mikroskopischen Operation ist das Vorgehen sehr ähnlich, nur wird statt eines Bohrloches eine kleine Eröffnung (ca. 5cm im Durchmesser, sogenannte Kraniotomie) am Schädel durchgeführt und dann mit Hilfe des Mikroskops der Tumor im Ventrikel entfernt. Danach wird der Knochen mittels resorbierbaren Platten und Schrauben verschlossen und die Haut mit selbstauflösenden Fäden zugenäht.
Unser erfahrenes Team der pädiatrischen Neurochirurgie berät Sie in Zusammenarbeit mit den Kollegen der Kinderonkologie zu der optimalen Therapie Ihres Kindes im jeweiligen Fall.
Alle Tumoroperationen finden bei uns mit sogenannter Navigation statt, das heisst, dass wir mithilfe von Computerbildern des Schädels ein millimetergenaues Abbild des Schädels und des Gehirns bekommen mit dessen Hilfe wir uns bei der Operation orientieren. Bei allen Kindern wird direkt nach der Operation, in derselben Narkose, ein MRT durchgeführt, um die chirurgische Tumorentfernung zu beurteilen. Falls es unerwarteterweise noch einen Tumorrest haben sollte, wird ihr Kind eventuell direkt erneut in den Operationssaal gebracht, um diese Reste zu entfernen. Nach der Operation und dem MRT werden die Kinder auf der Kinder-Intensivstation überwacht.
Therapie
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie am UKBB betreut. Falls Ihr Kind nicht notfallmässig über unsere Notfallstation am UKBB eingetreten ist, tritt Ihr Kind einen Tag vor der Operation ein und wird durch unser Team der pädiatrischen Neurochirurgie und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Kinder-Intensivpflegestation (1. Stock). Kinder welche notfallmässig eintreten und in einem wachen Zustand sind werden über die Nacht auf unsere Kinder-Intensivstation engmaschig überwacht, worauf die Operation dann häufig am Folgetag geplant wird. Sehr selten muss die Operation als Notfall sofort durchgeführt werden. Am Operationstag steht Ihnen eine unserer Elternbegleiterinnen vom Eltern Begleitungsservice (BELOP) am UKBB zur Verfügung. Sie begleiten die Eltern, bis das Kind eingeschlafen ist und zeigen den Eltern, wo es wieder aufwachen wird. Zwischendurch helfen sie Ihnen, sich im Spital zurechtzufinden. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht (in der Regel am Tag nach der Operation), kommt es auf die kinderchirurgische Bettenstation (3. Stock, Station B). In der Regel erholt sich Ihr Kind nach 5-7 Tagen von der Operation und darf auch in diesem Zeitraum nach Hause austreten. In gewissen Fällen wird Ihr Kind eine Neurorehabilitation brauchen, diese wird durch unser Team evaluiert und falls notwendig auch organisiert. Anschliessend wird die weitere Behandlung, wie sie im Rahmen eines Kinder-Tumor Boards mit den verschiedenen Fachdisziplinen festgelegt wurde, weitergeführt. Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Spitalaufenthalt
Was ist die Prognose bei Plexus-Tumoren, low grade Gliomen und high grade Gliomen?
Plexus Papillome sind gutartige Tumore und haben daher eine sehr gute Prognose. Nach der Operation sind die meisten Patienten geheilt und haben ein gutes Langzeitüberleben. Leider haben Patienten mit einem Plexus Karzinom eine schlechtere Prognose, da der Tumor trotz Therapie wieder wachsen kann (sogenanntes Rezidiv).
Obschon Komplikationen bei der Operation vorkommen können, sind diese selten und kommen bei ca. 3% der Fälle vor. Da die Plexus Tumore häufig Hirnwasser produzieren brauchen ca. 30-40% der Patienten auch nach einer kompletten Tumorentfernung einen sogenannten ventrikulo-peritonealen Shunt (siehe Factsheet «Hydrocephalus»). Es kann in seltenen Fällen zu Infektionen, einer Ansammlung von Hirnflüssigkeit unter der Haut (sogenanntes Liquor Kissen) oder Austritt von Hirnwasser durch die Haut, (sogenanntes Liquor Leck), einer Blutung im Bereich der Operation, einem Hirnschlag sowie zu neurologischen Ausfällen kommen. Kinder haben allerdings ein grosses Potential, sich von solchen Komplikationen zu erholen.
Literatur
Weiterführende Literatur
Ebel F, Greuter L, Guzman R, Soleman J. Transitional Care in Pediatric Brain Tumor Patients: A Systematic Literature Review. Child (Basel, Switzerland). 2022;9(4). doi:10.3390/children9040501
Ebel F, Greuter L, Licci M, Guzman R, Soleman J. Endoscopic and Endoscopically-Assisted Resection of Intraventricular Lesions Using a Neuroendoscopic Ultrasonic Aspirator. J Clin Med. 2021;10(17). doi:10.3390/jcm10173889
Ebel F, Greuter L, Guzman R, Soleman J. Resection of brain lesions with a neuroendoscopic ultrasonic aspirator - a systematic literature review. Neurosurg Review. 2022 doi: 10.1007/s10143-022-01837-w
https://www.mdpi.com/journal/children/special_issues/Brain_Tumors_Children
Niedrig-gradige Gliome (Low-grade Gliome)
Die wichtigsten Punkte
- Niedrig-gradige Gliome (genannt auch low-grade Gliome) sind in der Regel weniger aggressive Tumore.
- Symptome von Hirntumoren bei Kindern können sehr vielfältig sein, unter anderem Kopfschmerzen, Übelkeit, motorische Ausfälle und epileptische Anfälle treten auf.
- Bei niedrig-gradige Gliomen ist die vollständige operative Entfernung meistens heilend.
- Neue Therapieformen wie «targeted» Therapie sind ein wichtiger Bestandteil der Therapie geworden.
- Die Prognose bei niedrig-gradige Gliomen ist insgesamt sehr günstig.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was sind niedrig-gradige Gliome?
Gliome sind die häufigste Gruppe von Hirntumoren und beinhalten alle Tumore, die aus den sogenannten Gliazellen entstehen können (also Astrozytome aus den Astrozyten, Oligodendrogliome aus den Oligendrozyten etc.). Die Gliome können in niedriggradige (low grade) und hochgradige (high grade) Gliome eingeteilt werden, wobei oftmals die molekulare/genetische Zusammensetzung der Gliome eine Rolle für die Einteilung spielt. Die meisten Gliome zeigen eine Mutation der sogenannten Isocitratdehydrogenase (IDH). Weitere häufige Mutationen sind 1p/19q Codeletionen, bei denen Informationen auf den Genen gelöscht wurden, TP53 Mutationen, bei denen ein wichtiger Zellwachstumsstopper ausfällt, EGFR und TERT Mutationen, bei denen Rezeptoren, die Zellsignale weitergeben mutiert sind sowie BRAF Mutationen, bei denen ebenfalls ein Rezeptor für Zellsignale mutiert ist.
Low grade Gliome kann man in fünf Entitäten unterteilen: das pilozytischeAstrozytom, das diffuse Astrozytom, das angiozentrische Gliom, den polymorphen niedrig-gradigem neuroepithelialen Tumor der Jungen und das diffuse niedrig-gradigem Gliom. Für das pilozytische Astrozytom, ebenfalls ein low grade Gliom, verweisen wir gerne auf das Factsheet «Tumore der hinteren Schädelgrube». Das diffuse Astrozytom (mit einer sogenannten MYB Mutation) zeigt sich meist durch nicht medikamentös behandelbare Epilepsien im Kindesalter. Ebenfalls mit Epilepsien präsentiert sich typischerweise das angiozentrische Gliom, das vor allem im Kindes- und Teenageralter vorkommt. Beim polymorphen niedrig-gradigem neuroepithelialen Tumor der Jungen und dem diffusen niedrig-gradigem Gliom ist der sogenannte MAPK Weg mutiert, ein Rezeptor für Zellsignale. Low grade Gliome des Kindesalters unterscheiden sich von low-grade Gliome im Erwachsenen Alter in dem sie andere molekular-genetische Marker aufweisen und selten in high grade Gliome mutieren. Nicht selten werden low-grade Gliome inzidentell (per Zufall) in einer Bildgebung entdeckt, da spricht man von Inzidentalome. Die Behandlung von Inzidentalome bei Kindern ist ebenfalls unterschiedlich als bei Erwachsenen Patienten.
Symptome
Was sind typische Zeichen eines niedrig-gradigen Glioms?
Hirntumore können sich mit verschiedenen Zeichen äussern. Gemein haben sie aber die Zeichen eines erhöhten Hirndrucks (Kopfschmerzen, Übelkeit und Erbrechen), neurologische Ausfälle mit insbesondere Gangstörungen, Störungen der Feinmotorik (zunehmende «Ungeschicklichkeit»), Doppeltsehen, Schielen, Störungen der Augenbewegungen und Störungen der Sprache und/oder des Sprachverständnis. Bei Säuglingen kann sich ein Hirntumor durch rasches oder unnatürliches Kopfwachstum, eine gespannte und pralle Fontanelle durch einen Wasserkopf (siehe Factsheet «Hydrocephalus»), Entwicklungsverzögerungen oder leichte Reizbarkeit präsentieren. Low grade Gliome verursachen nicht selten auch epileptische Anfälle.
Leider sind die meisten Symptome eines Hirntumors eher unspezifisch (z.B. Erbrechen, was oft als eine Magen-Darm-Grippe fehlinterpretiert werden kann), was das korrekte Erkennen eines Tumors oft verzögert. Meist vergehen 6-12 Monaten bevor die Symptome korrekt mit dem Tumor in Verbindung gebracht wird.
Diagnose
Wie niedrig-gradige Gliome diagnostiziert?
Der Verdacht auf einen Hirntumor wird meist mit einer Bildgebung des Kopfes in Form einer Magnet Resonanz Tomographie (MRT) bestätigt.
Die Tumorart kann aber im MRT nicht sicher bestimmt werden, weshalb es in der Regel eine Operation (entweder Entfernung oder die Entnahme einer Gewebeprobe) braucht.
Ein paar wenige kindliche Hirntumore kann man mit gewissen MRT-Kriterien zusammen mit klinischen Zeichen diagnostizieren und behandeln, ohne eine vorherige Operation machen zu müssen. Alle Kinder mit Hirntumoren bekommen zusätzlich ein MRT der gesamten spinalen Achse (MRT des Rückens) um sogenannte Abtropf-Metastasen im Bereich des Rückenmarks auszuschliessen.
Die Gewebsanalyse des Tumors wird genauestens durch unsere Neuropathologie, das schweizweite Referenzzentrum für kindliche Hirntumoren, analysiert.
Prognose
Was sind Behandlungsmöglichkeiten bei niedrig-gradigen Gliomen?
Die Therapie der Gehirntumoren ist in erster Linie die chirurgische Entfernung des Tumors, kann aber auch aus einer Kombination von Operation, Strahlentherapie und Chemotherapie, oder nur aus einer Chemotherapie und/oder Bestrahlung bestehen.
Low grade Gliome werden in der Regel chirurgisch entfernt und brauchen danach, bei kompletter Entfernung, oft keine weitere Behandlung. Eine Ausnahme stellen sogenannte Inzidentalome dar, also Läsionen/Tumore, die zufällig entdeckt wurden und keine neurologischen Symptome verursachen. In diesen Fällen ist es bei Kindern üblich, eine konservative Behandlung mittels klinischen und MRT-Nachkontrollen einzuleiten. Wenn im Verlauf der Tumor einen Grössenwachstum zeigt, gewisse Kriterien im MRI Befund erfüllt oder zu Symptomen führt, wird eine Operation zur Tumorentfernung oder -biopsie empfohlen.
Dafür wird das Kind auf dem Rücken gelagert und man macht einen Hautschnitt, um zum Schädelknochen zu kommen. Danach wird ein je nach Grösse und Lokalisation des Tumors ein die Schädelkalotte eröffnet (die Grösse der Öffnung ist von der Tumorgrösse abhängig), durch das man dann den Tumor entfernen kann. Anschliessend wird sowohl die Schädelkalotte wie auch die Muskulatur und die Haut wieder verschlossen. Der Knochen wird mittels resorbierbaren Platten und Schrauben verschlossen. Die Haut wird mit resorbierbarem Fadenmaterial zugenäht.
Low-grade Gliome, die nicht komplett zu entfernen sind, in der Regel weil sie an sogenannten eloquenten Hirnareale liegen (sprich Hirnareale mit einer wichtigen neurologischen Funktion) und eine komplette Resektion schwerwiegende neurologische Defizite mit sich bringen kann, kann man mittels Chemotherapie und/oder Bestrahlung behandeln. In der Regel geschieht dies erst wenn ein Wachstum des Tumorrestes im Rahmen der Nachkontrollen sich zeigen. Manchmal, bei Rückfällen oder Wachstum eines Tumorrestes, werden niedrig-gradige Gliome mehrmals operiert. Seit ein paar Jahren, können unsere Kollegen der Pathologie, welche das Referenzzentrum für die Diagnose von kindlichen Hirntumoren in der Schweiz sind, die Genetik (sogenannte molekular Genetik) des Tumors analysieren. Bei gewissen genetischen Veränderungen innerhalb des Tumors kann dann eine sogenannte «targeted therapie» (gezielte Therapie) eingeleitet werden.
Alle Kinder mit Hirntumoren am UKBB werden an unserem Kinder-Neuroonkologie Board, bestehend aus Kinderneuroonkologen, Kinderneurochirurgen, Kinderneurologen, Strahlentherapeuten, Pathologen und Kinderonkologisches Pflegepersonal besprochen und im Anschluss von unserem hochspezialisierten Team gesehen und beraten.
Therapie
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie am UKBB betreut. Falls Ihr Kind nicht notfallmässig über unsere Notfallstation am UKBB eingetreten ist, tritt Ihr Kind einen Tag vor der Operation ein und wird durch unser Team der pädiatrischen Neurochirurgie und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Kinder-Intensivpflegestation (1. Stock). Kinder welche notfallmässig eintreten und in einem wachen Zustand sind werden über die Nacht auf unsere Kinder-Intensivstation engmaschig überwacht, worauf die Operation dann häufig am Folgetag geplant wird. Sehr selten muss die Operation als Notfall sofort durchgeführt werden. Am Operationstag steht Ihnen eine unserer Elternbegleiterinnen vom Eltern Begleitungsservice (BELOP) am UKBB zur Verfügung. Sie begleiten die Eltern, bis das Kind eingeschlafen ist und zeigen den Eltern, wo es wieder aufwachen wird. Zwischendurch helfen sie Ihnen, sich im Spital zurechtzufinden. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht (in der Regel am Tag nach der Operation), kommt es auf die kinderchirurgische Bettenstation (3. Stock, Station B). In der Regel erholt sich Ihr Kind nach 5-7 Tagen von der Operation und darf auch in diesem Zeitraum nach Hause austreten. In gewissen Fällen wird Ihr Kind eine Neurorehabilitation brauchen, diese wird durch unser Team evaluiert und falls notwendig auch organisiert. Anschliessend wird die weitere Behandlung, wie sie im Rahmen eines Kinder-Tumor Boards mit den verschiedenen Fachdisziplinen festgelegt wurde, weitergeführt. Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Spitalaufenthalt
Was ist die Prognose bei niedrig-gradigen Gliomen?
Die Prognose der Gehirntumoren ist abhängig von der Art des Tumors, der Lage, der Ausbreitung bei Diagnosestellung und des Resektionsausmasses des Tumors.
Für das diffuse Astrozytom, das angiozentrische Gliom und der polymorphe niedriggradige neuroepitheliale Tumor der Jungen ist die vollständige chirurgische Entfernung kurativ (heilend), sie zeigen ein sehr gutes Langzeitüberleben. Das diffuse niedriggradige Gliom hat eine unterschiedlich gute Prognose, sie ist sowohl von der Lage, dem Alter und der molekularen (genetischen) Zusammensetzung des Tumors abhängig.
Obschon Komplikationen bei der Operation vorkommen können, sind diese selten und hängen davon ab, wo sich der Tumor im Hirn befindet. Die Gesamtkomplikationsrate ist bei ca. 3%, bei Operationen in der Nähe von wichtigen Hirnstrukturen (eloquente Areale) kann es auch in 5-10% der Fälle zu Komplikationen kommen. Es kann in seltenen Fällen zu Infektionen, einer Hirnflüssigkeitsansammlung unter der Haut (sogenanntes Liquorkissen), oder Austritt von Hirnflüssigkeit (Liquor) aus der Haut (sogenanntes Liquorleck), einem Hydrocephalus (siehe Factsheet «Hydrocephalus») einer Blutung im Bereich der Operation, einem Hirnschlag sowie zu neurologischen Ausfällen kommen. Manchmal können diese Komplikationen zu weiteren Eingriffen führen. Kinder haben allerdings ein deutlich grösseres Potential, sich von solchen Komplikationen zu erholen.
Literatur
Weiterführende Literatur
Hayden Gephart MG, Colglazier E, Paulk KL, Vogel H, Guzman R, Edwards MSB. Primary pediatric skull tumors. Pediatr Neurosurg. 2011;47(3):198-203. doi:10.1159/000330544
Gephart MGH, Taft BP, Giese A-K, Guzman R, Edwards MSB. Perioperative posterior reversible encephalopathy syndrome in 2 pediatric neurosurgery patients with brainstem ependymoma. J Neurosurg Pediatr. 2011;7(3):235-237. doi:10.3171/2010.12.PEDS10299
Greuter L, Guzman R, Soleman J. Typical Pediatric Brain Tumors Occurring in Adults-Differences in Management and Outcome. Biomedicines. 2021;9(4). doi:10.3390/biomedicines9040356
Soleman J, Kozyrev DA, Ben-Sira L, Constantini S, Roth J. Management of incidental brain tumors in children: a systematic review. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2020;36(8):1607-1619. doi:10.1007/s00381-020-04658-8
Soleman J, Dvir R, Ben-Sira L, et al. MRI-based diagnosis and treatment of pediatric brain tumors: is tissue sample always needed? Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2021;37(5):1449-1459. doi:10.1007/s00381-021-05148-1
Soleman J, Roth J, Ram Z, Yalon M, Constantini S. Malignant transformation of a conservatively managed incidental childhood cerebral mass lesion: controversy regarding management paradigm. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2017;33(12):2169-2175. doi:10.1007/s00381-017-3566-z
Roth J, Soleman J, Paraskevopoulos D, Keating RF, Constantini S. Incidental brain tumors in children: an international neurosurgical, oncological survey. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2018;34(7):1325-1333. doi:10.1007/s00381-018-3836-4
Greuter L, Guzman R, Soleman J. Pediatric and Adult Low-Grade Gliomas: Where Do the Differences Lie? Child (Basel, Switzerland). 2021;8(11). doi:10.3390/children8111075
Ebel F, Greuter L, Guzman R, Soleman J. Transitional Care in Pediatric Brain Tumor Patients: A Systematic Literature Review. Child (Basel, Switzerland). 2022;9(4). doi:10.3390/children9040501
Ebel F, Greuter L, Licci M, Guzman R, Soleman J. Endoscopic and Endoscopically-Assisted Resection of Intraventricular Lesions Using a Neuroendoscopic Ultrasonic Aspirator. J Clin Med. 2021;10(17). doi:10.3390/jcm10173889
https://www.mdpi.com/journal/children/special_issues/Brain_Tumors_Children
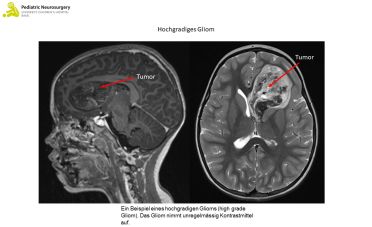
Hoch-gradige Gliome (High-grade Gliome)
Die wichtigsten Punkte
- Hoch-gradige Gliome (genannt auch high-grade Gliome) sind in der Regel aggressive Tumore
- Symptome von Hirntumoren bei Kindern können sehr vielfältig sein, unter anderem Kopfschmerzen, Übelkeit und motorische Ausfälle treten auf
- Bei hoch-gradige Gliomen ist die Operation zusammen mit Strahlen- und Chemotherapie die Therapie der Wahl
- Die Prognose bei hoch-gradige Tumoren und ist eherungünstig
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was sind hoch-gradige Gliome?
Gliome: Gliome sind die häufigste Gruppe von Hirntumoren und beinhalten alle Tumore, die aus den sogenannten Gliazellen entstehen können (also Astrozytome aus den Astrozyten, Oligodendrogliome aus den Oligendrozyten etc.). Die Gliome können in niedrig-gradige (low-grade) und hoch-gradige (high-grade) Gliome eingeteilt werden, wobei oftmals die molekulare/genetische Zusammensetzung der Gliome eine Rolle für die Einteilung spielt. Die meisten Gliome zeigen eine Mutation der sogenannten Isocitratdehydrogenase (IDH). Weitere häufige Mutationen sind 1p/19q Codeletionen, bei denen Informationen auf den Genen gelöscht wurden, TP53 Mutationen, bei denen ein wichtiger Zellwachstumsstopper ausfällt, EGFR und TERT-Mutationen, bei denen Rezeptoren, die Zellsignale weitergeben mutiert sind sowie BRAF Mutationen, bei denen ebenfalls ein Rezeptor für Zellsignale mutiert ist.
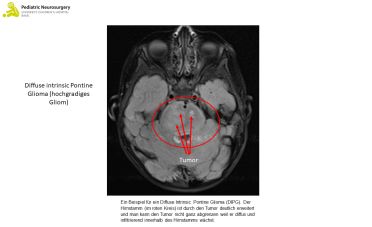
Bei high-grade Gliomen unterscheidet man das diffuse Mittelliniengliom, das diffuse pädiatrische high grade Gliom (H3 und IDH-Wildtyp), auch diffuse intrinsic pontine glioma (DIPG) genannt, sowie das bei Kindern typische hemisphärische Gliom.
Das diffuse Mittelliniengliom ist ein hochgradiger (aggressiver) in das umliegende Gewebe einwandernder Tumor, den man auch im Rückenmark finden kann. Wahrscheinlich entstehen sie durch eine Mutation des sogenannten H3 Gens (ein Gen, das für die Aufwicklung der Erbinformation, der DNA, verantwortlich ist). Das Mittelliniengliom macht ca. 20% der kindlichen Tumore aus und ca. 1/3 der Tumore sind hochgradig. Etwa 80% der Mittelliniengliome wachsen in der Brücke (auch Pons genannt), welches ein Teil des Hirnstamms ist. Sie können aber auch im Rückenmark vorkommen. Betroffene Kinder sind meist zwischen 5 und 9 Jahren alt.
Das DIPG kann während des gesamten Kindesalters auftreten. Es entsteht und liegt in der Regel in der Brücke. Ähnlich wie beim diffusen Mittelliniengliom sind Kinder zwischen 5 und 9 Jahren und mehr Mädchen als Kanben betroffen. Die meisten DIPGs sind histologisch hochgradige Astrozytome. Das DIPG zeichnet sich durch Mutationen im H3 Gen, TP53 oder durch einen IDH-Wildtyp aus.
Das diffuse hemisphärische Gliom ist ein aggressiver Tumor, der oftmals im Teenageralter auftritt. Er zeichnet sich durch eine TP53 Mutation aus. Oft ist das hemisphärische Gliom mit weiteren genetischen Erkrankungen assoziiert z.B. einer TP53 Mutation oder einer sogenannten X-linked α-Thalassämie.
Im Vergleich zu Erwachsenen Patienten ist es sehr selten, dass hoch-gradige Gliome aus niedrig-gradige Gliome (sogenannte maligne Transformation) entstehen. In seltenen Fällen ist dies jedoch auch bei Kindern möglich.
Symptome
Was sind typische Zeichen von hoch-gradigen Gliomen?
Hirntumore können sich mit verschiedenen Zeichen äussern. Gemein haben sie aber die Zeichen eines erhöhten Hirndrucks (Kopfschmerzen, Übelkeit und Erbrechen), neurologische Ausfälle mit insbesondere Gangstörungen, Störungen der Feinmotorik (zunehmende «Ungeschicklichkeit»), Doppeltsehen, Schielen, Störungen der Augenbewegungen und Störungen der Sprache und/oder des Sprachverständnis. Bei Säuglingen kann sich ein Hirntumor durch rasches oder unnatürliches Kopfwachstum, eine gespannte und pralle Fontanelle durch einen Wasserkopf (siehe Factsheet «Hydrocephalus»), Entwicklungsverzögerungen oder leichte Reizbarkeit präsentieren. In seltenen Fällen können.
Leider sind die meisten Symptome eines Hirntumors eher unspezifisch (z.B. Erbrechen, was oft als eine Magen-Darm-Grippe fehlinterpretiert werden kann), was das korrekte Erkennen eines Tumors oft verzögert. Oft vergehen 6-12 Monaten bevor die Symptome korrekt mit dem Tumor in Verbindung gebracht wird, insbesondere bei langsam wachsenden Hirntumoren.
Diagnose
Wie werden hoch-gradige Gliome diagnostiziert?
Der Verdacht auf einen Hirntumor wird meist mit einer Bildgebung des Kopfes in Form einer Magnet Resonanz Tomographie (MRT) bestätigt.
Die Tumorart kann aber im MRT nicht sicher bestimmt werden, weshalb es in der Regel eine Operation (entweder Entfernung oder die Entnahme einer Gewebeprobe) braucht.
Ein paar wenige kindliche Hirntumore (z.B. das DIPG) kann man mit gewissen MRT-Kriterien zusammen mit klinischen Zeichen diagnostizieren und behandeln, ohne eine vorherige Operation machen zu müssen. Alle Kinder mit Hirntumoren bekommen zusätzlich ein MRT der gesamten spinalen Achse (MRT des Rückens) um sogenannte Abtropf-Metastasen im Bereich des Rückenmarks auszuschliessen.
Die Gewebsanalyse des Tumors wird genauestens durch unsere Neuropathologie, das schweizweite Referenzzentrum für kindliche Hirntumoren, analysiert.
Prognose
Was sind Behandlungsmöglichkeiten bei hoch-gradigen Gliomen?
Die Therapie der Gehirntumoren ist in erster Linie die chirurgische Entfernung des Tumors, kann aber auch aus einer Kombination von Operation, Strahlentherapie und Chemotherapie, oder nur aus einer Chemotherapie und/oder Bestrahlung bestehen.
Bei den hoch-gradigen Gliomen kommt die Entscheidung, ob eine chirurgische Entfernung oder eine Gewebsentnahme (Biopsie) durchgeführt werden sollte, auf die Lokalisation des Tumors an. In der Regel wird eine möglichst vollständige chirurgische Entfernung des Tumors angestrebt, da die Tumorentfernung der Faktor ist, der die Prognose am stärksten beeinflusst. Die genaue Operationstechnik ist abhängig von der Lokalisation, aber im Prinzip wird das Kind in den meisten Fällen auf dem Rücken gelagert und man macht einen Hautschnitt, um zum Schädelknochen zu kommen. Danach wird ein je nach Grösse und Lokalisation des Tumors die Schädelkalotte eröffnet (die Grösse der Öffnung ist von der Tumorgrösse abhängig), durch das man dann den Tumor entfernen kann. Anschliessend wird sowohl die Schädelkalotte wie auch die Muskulatur und die Haut wieder verschlossen. Der Knochen wird mittels resorbierbaren Platten und Schrauben verschlossen. Die Haut wird mit resorbierbarem Fadenmaterial zugenäht. Bei allen Kindern wird direkt nach der Operation, in derselben Narkose, ein MRT durchgeführt, um die chirurgische Tumorentfernung zu beurteilen. Falls es unerwarteterweise noch einen Tumorrest haben sollte, wird ihr Kind eventuell direkt erneut in den Operationssaal gebracht, um diese Reste zu entfernen. Nach der Operation und dem MRT werden die Kinder auf der Kinder-Intensivstation überwacht.
Die Mehrheit der hoch-gradigen Gliomen benötigt zusätzlich zur Operation eine Nachbehandlung mittels Chemo- und/oder Bestrahlungstherapie. Bei gewissen hoch-gradigen Gliomen wie z.B. dem DIPG ist eine Operation keine Option, da die Tumore in schwer erreichbaren Hirngebieten, die in direkter Nachbarschaft zu lebenswichtigen Hirnstrukturen, lokalisiert sind. Eine Bestrahlung des Tumors mit oder ohne Chemotherapie ist die Behandlung der Wahl in diesen Fällen.
Alle Kinder mit Hirntumoren am UKBB werden an unserem Kinder-Neuroonkologie Board, bestehend aus Kinderneuroonkologen, Kinderneurochirurgen, Kinderneurologen, Strahlentherapeuten, Pathologen und Kinderonkologisches Pflegepersonal besprochen und im Anschluss von unserem hochspezialisierten Team gesehen und beraten.
Therapie
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie am UKBB betreut. Falls Ihr Kind nicht notfallmässig über unsere Notfallstation am UKBB eingetreten ist, tritt Ihr Kind einen Tag vor der Operation ein und wird durch unser Team der pädiatrischen Neurochirurgie und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Kinder-Intensivpflegestation (1. Stock). Kinder welche notfallmässig eintreten und in einem wachen Zustand sind werden über die Nacht auf unsere Kinder-Intensivstation engmaschig überwacht, worauf die Operation dann häufig am Folgetag geplant wird. Sehr selten muss die Operation als Notfall sofort durchgeführt werden. Am Operationstag steht Ihnen eine unserer Elternbegleiterinnen vom Eltern Begleitungsservice (BELOP) am UKBB zur Verfügung. Sie begleiten die Eltern, bis das Kind eingeschlafen ist und zeigen den Eltern, wo es wieder aufwachen wird. Zwischendurch helfen sie Ihnen, sich im Spital zurechtzufinden. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht (in der Regel am Tag nach der Operation), kommt es auf die kinderchirurgische Bettenstation (3. Stock, Station B). In der Regel erholt sich Ihr Kind nach 5-7 Tagen von der Operation und darf auch in diesem Zeitraum nach Hause austreten. In gewissen Fällen wird Ihr Kind eine Neurorehabilitation brauchen, diese wird durch unser Team evaluiert und falls notwendig auch organisiert. Anschliessend wird die weitere Behandlung, wie sie im Rahmen eines Kinder-Tumor Boards mit den verschiedenen Fachdisziplinen festgelegt wurde, weitergeführt. Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Spitalaufenthalt
Was ist die Prognose bei hoch-gradigen Gliomen?
Die Prognose der Gehirntumoren ist abhängig von der Art des Tumors, der Lage, der Ausbreitung bei Diagnosestellung und des Resektionsausmasses des Tumors.
Im Allgemeinen ist die Prognose bei hoch-gradigen Gliomen limitiert, da die Therapie, die uns heutzutage zur Verfügung stehen, den Tumor in der Regel nicht heilen kann. Jedoch ist die Prognose häufig von der Tumorlokalisation, Tumor-Genetik (molekular Genetik) und auch das Ausmass der Resektion welches erreicht wurde abhängig. Obschon Komplikationen bei der Operation vorkommen können, sind diese selten und hängen davon ab, wo sich der Tumor im Hirn befindet. Die Gesamtkomplikationsrate ist bei ca. 3%, bei Operationen in der Nähe von wichtigen Hirnstrukturen (eloquente Areale) kann es auch in 5-10% der Fälle zu Komplikationen kommen. Es kann in seltenen Fällen zu Infektionen, einer Hirnflüssigkeitsansammlung unter der Haut (sogenanntes Liquorkissen), oder Austritt von Hirnflüssigkeit (Liquor) aus der Haut (sogenanntes Liquorleck), einem Hydrocephalus (siehe Factsheet «Hydrocephalus») einer Blutung im Bereich der Operation, einem Hirnschlag sowie zu neurologischen Ausfällen kommen. Manchmal können diese Komplikationen zu weiteren Eingriffen führen. Kinder haben allerdings ein deutlich grösseres Potential, sich von solchen Komplikationen zu erholen.
Literatur
Weiterführende Literatur
Franceschi E, Hofer S, Brandes AA, Guzman R et al. EANO-EURACAN clinical practice guideline for diagnosis, treatment, and follow-up of post-pubertal and adult patients with medulloblastoma. Lancet Oncol. 2019;20(12):e715-e728. doi:10.1016/S1470-2045(19)30669-2
Hayden Gephart MG, Colglazier E, Paulk KL, Vogel H, Guzman R, Edwards MSB. Primary pediatric skull tumors. Pediatr Neurosurg. 2011;47(3):198-203. doi:10.1159/000330544
Gephart MGH, Taft BP, Giese A-K, Guzman R, Edwards MSB. Perioperative posterior reversible encephalopathy syndrome in 2 pediatric neurosurgery patients with brainstem ependymoma. J Neurosurg Pediatr. 2011;7(3):235-237. doi:10.3171/2010.12.PEDS10299
Greuter L, Guzman R, Soleman J. Typical Pediatric Brain Tumors Occurring in Adults-Differences in Management and Outcome. Biomedicines. 2021;9(4). doi:10.3390/biomedicines9040356
Soleman J, Dvir R, Ben-Sira L, et al. MRI-based diagnosis and treatment of pediatric brain tumors: is tissue sample always needed? Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2021;37(5):1449-1459. doi:10.1007/s00381-021-05148-1
Soleman J, Roth J, Ram Z, Yalon M, Constantini S. Malignant transformation of a conservatively managed incidental childhood cerebral mass lesion: controversy regarding management paradigm. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2017;33(12):2169-2175. doi:10.1007/s00381-017-3566-z
Roth J, Soleman J, Paraskevopoulos D, Keating RF, Constantini S. Incidental brain tumors in children: an international neurosurgical, oncological survey. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2018;34(7):1325-1333. doi:10.1007/s00381-018-3836-4
Greuter L, Guzman R, Soleman J. Pediatric and Adult Low-Grade Gliomas: Where Do the Differences Lie? Child (Basel, Switzerland). 2021;8(11). doi:10.3390/children8111075
Ebel F, Greuter L, Guzman R, Soleman J. Transitional Care in Pediatric Brain Tumor Patients: A Systematic Literature Review. Child (Basel, Switzerland). 2022;9(4). doi:10.3390/children9040501
Ebel F, Greuter L, Licci M, Guzman R, Soleman J. Endoscopic and Endoscopically-Assisted Resection of Intraventricular Lesions Using a Neuroendoscopic Ultrasonic Aspirator. J Clin Med. 2021;10(17). doi:10.3390/jcm10173889
https://www.mdpi.com/journal/children/special_issues/Brain_Tumors_Children
Chiari Malformation Typ I und Syringomyelie
Die wichtigsten Punkte
- Als Chiari Malformation Typ I (CMI) werden relativ seltene Fehlbildungen im hinteren Bereich des Kopfes und am Übergang zum Rückenmark bezeichnet. Eine Syringomyelie beschreibt einen flüssigkeitsgefüllten Hohlraum im Rückenmark und tritt oft zusammen mit einer CMI auf.
- Eine CMI ist meistens angeboren, aber nicht vererbt. Die genaue Entstehung ist nicht geklärt.
- 90 Prozent der CMI-Fälle sind Zufallsbefunde, bei denen keine Symptome auftreten und auch keine Therapien notwendig sind.
- Auftretende Symptome infolge einer CMI können wenig bis schwerstgradig einschränkend sein. Sie lassen sich chirurgisch behandeln und führen bei rund 80 Prozent der Patient*innen zu einer Verbesserung. Ähnlich verhält es sich mit Symptomen und Behandlung einer Syringomyelie.
- Die Prognose hängt von den Symptomen und Schweregrad der Syringomyelie ab.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was ist eine Chiari Malformationen Typ I (CMI)?
Die Chiari Malformationen Typ I (CMI) ist eine meistens angeborene strukturelle Anomalie im Bereich des Kleinhirns, Hirnstamms und am Übergang zum Rückenmark. Dabei liegen die sogenannten Kleinhirnmandeln oder Kleinhirntonsillen entweder mit oder ohne Hirnstamm mehr als fünf Millimeter tief im Rückenmarkskanal (sogenannte Kleinhirntonsillen-Ektopie).
Eine CMI kommt bei etwa 1 bis 3 Prozent der Gesamtbevölkerung vor und ist somit relativ selten.
Nur in 10 Prozent der Fälle treten Symptome auf, die eine Behandlung erfordern. 90 Prozent der CMI-Fälle sind Zufallsbefunde und benötigen keinerlei Therapie.
Die Ursachen einer angeborenen CMI sind noch nicht gänzlich geklärt. Zur Entstehung der CMI gibt es mehrere Theorien. Jedoch vermag bislang keine alle Erscheinungsbilder abzudecken. Eine der Theorien führt das Auftreten einer angeborenen CMI auf eine Veränderung im Erbgut (Mutation) während der Entwicklung des Nervensystems zurück. Diese spontane Mutation würde die korrekte Weiterentwicklung stören. Eine Vererbung wird nicht beobachtet.
Eine weitere Theorie führt die Entstehung einer CMI auf die engen Platzverhältnisse in der hinteren Schädelgrube (hinterer Bereich des Kopfes) zurück, die während der Entwicklung des Nervensystems vorliegen. Die Enge könne dazu führen, dass die dortigen Gehirnstrukturen durch die Öffnung gequetscht werden, die das Rückenmark und den Schädel verbindet (Foramen magnum).
Zu einer CMI können zudem gewisse Krankheitsbilder führen. Man spricht dann von einer sekundären CMI. Hirntumore, Hydrocephalus (Wasserkopf), Liquorverlustsyndrom (spontaner Verlust von Hirnwasser, typischerweise im Bereich vom Rücken nach einer Lumbalpunktion) und Anhaften des Rückenmarks an die umliegenden Strukturen (sogenanntes Tethered cord) können alle sekundär zu einer CMI führen. In solchen Fällen sollte die Ursache zuerst behandelt werden. Eine CMI kann ebenfalls gehäuft in Kombination mit gewissen Syndromen auftreten (Robin Sequenz, Neurofibromatose I Typ Recklinghausen und Noonan Syndrom).
Was ist eine Syringomyelie?
Eine Syringomyelie beschreibt einen flüssigkeitsgefüllten Hohlraum innerhalb des Rückenmarks und tritt oftmals zusammen mit einer CMI auf. Sie kann aber auch durch andere Ursachen bedingt sein: infektiös, entzündlich, traumatisch oder durch einen Hydrocephalus (Wasserkopf) oder eine Raumforderung (z.B. Tumor). Die Syringomyelie im Rahmen einer CMI kommt wahrscheinlich zustande, wenn die CMI zu einem erhöhten Druck im Gehirn führt und daraufhin Hirnwasser in das Rückenmark austritt. Dieser Druck baut sich auf, wenn der Rückfluss des Hirnwassers in den Schädel am Übergang zwischen Rückenmark und Gehirn blockiert ist. Mit der Zeit wird die angesammelte Flüssigkeit in das umliegende Gewebe gepresst. Es kommt zu einer Schwellung des Gewebes (Ödem) und in der Folge weitet das Ödem das Rückenmark auf (sogenannte Syrinx oder Syringomyelie).
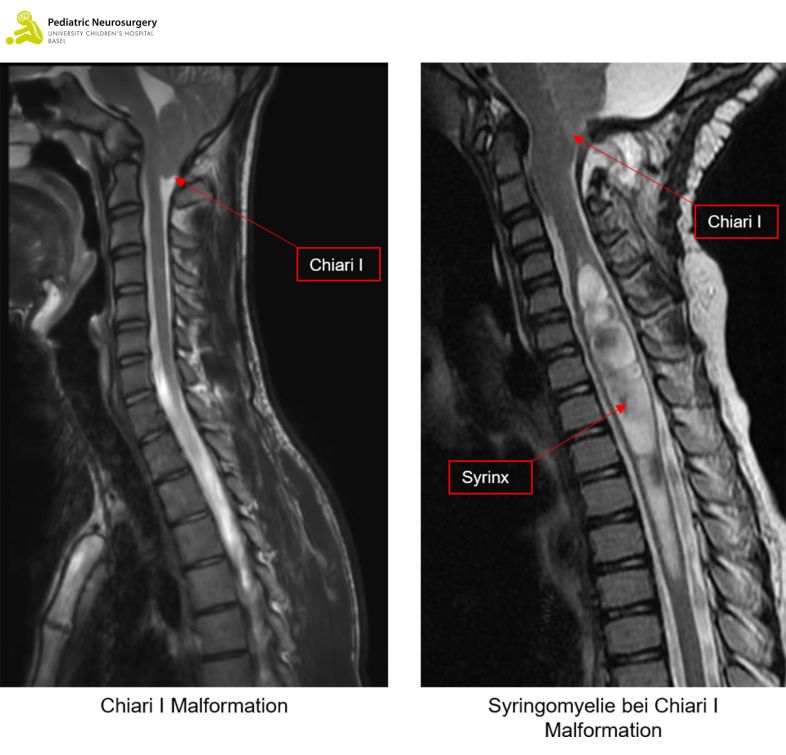
Abbildung 1: Chiari I Malformation und Syringomyelie.
Symptome
Was sind typische Zeichen einer Chiari Malformationen Typ I (CMI)
Bei 90
Prozent der CMI-Fälle handelt es sich um «inzidentelle Chiari-Malformationen»,
d.h. es treten keine Symptome auf. In den symptomatischen Fällen sind die
typischen Zeichen Nackenschmerzen, die in den Hinterkopf ausstrahlen, sowie ein
Taubheitsgefühl in den Fingern und Zehenspitzen etwa beim Husten, Niesen oder bei
Anstrengung. Weitere, seltenere Symptome sind eine Verformung des Rückens
(Skoliose), das Auftreten eines Wasserkopfes (Hydrocephalus) und
Hirnnervenausfälle, die sich bemerkbar machen als Heiserkeit, Stummheit,
Schluckprobleme, wiederholtes Verschlucken, abnormale Augenbewegungen,
Muskelschwächen oder Schlafapnoe (Aussetzen der Spontanatmung während des
Schlafens).
Die Symptome können sowohl im Kleinkindalter, aber auch erst in der Jugend beziehungsweise im früheren Erwachsenalter in Erscheinung treten.
Was sind typische Zeichen einer Syringomyelie
Eine
Syringomyelie zeigt eine grosse Bandbreite an Symptomen. In manchen Fällen
treten gar keine Symptome auf. Es kann aber auch zu Schmerzen oder zum Ausfall
des Schmerzempfindens oder Temperaturempfindens kommen. Ebenfalls bemerkbar machen können sich
Gangunsicherheit, Probleme mit dem Wasserlösen oder Stuhlgang (Inkontinenz) und
muskuläre Schwächen in den Armen oder Beinen. Seltener kann eine
Syringomyelie zu Störungen der Atmung und zu Schluckproblemen führen.
Diagnose
Wie wird eine Chiari Malformationen Typ I (CMI) diagnostiziert?
Bei Verdacht auf eine CMI oder Syringomyelie wird eine Bildgebung mittels Magnetresonanztomographie (MRI) vom Kopf und der Wirbelsäule durchgeführt. Oft wird eine CMI oder Syringomyelie auch zufällig bei einer MRI des Kopfes festgestellt, doch sofern keine Symptome vorhanden sind, ist dieser Zufallsbefund nicht behandlungsbedürftig. Ebenfalls kann eine CMI bereits während der Schwangerschaft mit einem pränatalen Ultraschall festgestellt werden.
Falls eine CMI im MRI
diagnostiziert wird, sollten möglich Ursachen hierfür (Tumor, tethered cord,
Liquorverlusstsyndrom, Hydrocephalus etc.) ausgeschlossen werden. Dies kann man
mit einer MRI-Untersuchung der gesamten spinalen Achse (Wirbelsäule und Kopf)
machen. Bei einer symptomatischen CMI werden wir für Ihr Kind weitere
Untersuchungen bei unseren Kolleg*innen der Augenmedizin, Hals-Nasen-Ohren-Medizin,
Kinderneurologie und eventuell der Schlafmedizin veranlassen, um sicherzustellen,
dass die Symptome durch die CMI verursacht werden.
Wie wird eine Syringomyelie diagnostiziert?
Bei der Diagnose einer Syringomyelie müssen ebenfalls mögliche Ursachen mittels einer MRI-Untersuchung der gesamten spinalen Achse ausgeschlossen werden. Falls die Syringomyelie Symptome verursacht, werden wir Ihr Kind durch Kolleg*innen aus der Kinderneurologie und eventuell Kinderurologie und -nephrologen mitbeurteilen lassen, also von Spezialist*innen der Harnwege und Harntrakt sowie Nieren. Eventuell wird auch eine Ultraschalluntersuchung der Blase und/oder Niere notwendig sein.
Therapie
Wie lässt sich eine Chiari Malformationen Typ I (CMI) behandeln?
Eine zufällig entdeckte CMI bedarf in der Regel keiner Therapie. Dabei kann der Krankheitsverlauf klinisch sowie mittels MRI nach einem Jahr nachkontrolliert werden. Falls die Situation stabil ist, braucht es in der Regel keine Nachkontrollen mehr.
Bei CMI-typischen Symptomen wird die chirurgische Therapie empfohlen. Das Ziel der chirurgischen Therapie ist die Entlastung der Ektopie im Übergang zwischen Hirn und Rückenmark. Dafür wird ein Teil vom Schädelknochen beim Übergang vom Hinterkopf zum Nacken (sogenannte extradurale Foramen Magnum Dekompression) sowie die hinteren Anteile der obersten Wirbelkörper im Nacken (sogenannte Laminektomie) entfernt, um zusätzlichen Platz für das Gehirn und dem Hirnstamm zu schaffen. Allenfalls ist es zusätzlich notwendig, die Hirnhaut (Dura) zu eröffnen, gegebenenfalls sogar die Kleinhirntonsillen zu verkleinern oder zu entfernen, um noch mehr Platz zu schaffen. Dies wird als intradurale Foramen magnum Dekompression bezeichnet. Durch diese Operationen wird der Druck im Kopf reduziert.
Das Kind wird unter Narkose in Bauchlage operiert. Es wird ein Schnitt am hinteren Schädel und oberen Nacken beim Übergang zum Rückenmark gemacht und dort ein Zugang zum Übergang eröffnet. Anschliessend wird ein Loch an der Hinterkante des Schädels gemacht (Kraniotomie) und der Dornfortsatz des ersten Halswirbelkörpers entfernt. Dann wird je nach Bedarf noch die Hirnhaut eröffnet, um die engen Platzverhältnisse zu erweitern. Wenn die Hirnhaut eröffnet wird, wird ein sogenannter Durapatch eingenäht. Dabei handelt es sich um eine künstliche Hirnhaut, die an die Schnittränder der echten, eröffneten Hirnhaut angenäht wird und die Hirnhaut somit wieder abdichtet. Anschliessend wird die Haut wieder verschlossen. Die gesamte Operation dauert ca. 2 bis 3 Stunden. Komplikationen einer Foramen magnum Dekompression sind selten (ca. 6%) und beinhalten Nacken- und Kopfschmerzen sowie das Risiko eines Hirnwasserlecks und einer Pseudomeningocele (Ansammlung von Hirnwasser unter der Haut).
Wie lässt sich eine Syringomyelie behandeln?
Falls eine begleitende Syringomyelie vorhanden ist, kann diese durch die CMI-Operation ebenfalls behoben werden. Falls dies nicht der Fall sein sollte, besteht mit der Syringomyelie-Operation eine weitere Möglichkeit, die überschüssige Hirnflüssigkeit aus dem Rückenmark abzuführen. Dabei wird ein Abflussröhrchen (sogenannter «Syringo-Subarachnoidalen Shunt») in den Raum zwischen Rückenmark und Hirnhäute eingelegt (Subarachnoidalraum). Durch dieses Röhrchen kann die Flüssigkeit entweder in das Lungenfell abfliessen (sogenannter «Syringo-Pleuraler Shunt»)oder in den Bauchraum(sogenannter «Syringo-Peritonealer Shunt»).
Die Komplikationsrate einer Syringomyelie-Operation ist gering und tritt bei ca. 3-5% der Fälle auf. Komplikationen können durch Verletzungen des Rückenmarks auftreten, welche zu einem Ausfall der Temperatur- oder Gefühlsempfindung oder aber auch zu muskulären Ausfällen führen können. Ebenfalls kann es zu einem Leck im Abflussröhrchen kommen, durch welches Hirnwasser austritt. In seltenen Fällen kann das Abflussröhrchen auch verstopfen und eine erneute Syringomyelie auftreten, was eine weitere Operation notwendig macht.
Spitalaufenthalt
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team der pädiatrischen Neurochirurgie im UKBB betreut. Ihr Kind tritt einen Tag vor der Operation ein und wird durch unser Team nochmals untersucht. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Intensivpflegestation.
Am Operationstag steht Ihnen eine Begleiterin vom Elternbegleitungsservice (BELOP) der Stiftung Pro UKBB zur Verfügung. Sie begleitet Sie, bis Ihr Kind eingeschlafen ist, und zeigt Ihnen, wo es wieder aufwachen wird. Zwischendurch hilft sie Ihnen, sich im Spital zurechtzufinden.
Sobald Ihr Kind keine engmaschige Überwachung mehr braucht, kommt es auf die kinderchirurgische Bettenstation (2. Stock, Station B). Während der gesamten Hospitalisation dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt. Sobald Ihr Kind sich von der Operation erholt hat, darf es wieder nach Hause.
Prognose
Welche Prognose haben eine behandelte Chiari Malformationen Typ I (CMI) und eine Syringomyelie?
Die Prognose der CMI ist schwer vorherzusagen und hängt von den Symptomen der Erkrankung ab. Manche Patient*innen zeigen nie Symptome, andere sind schwerstgradig eingeschränkt, und manche Patient*innen entwickeln erst sehr spät Beschwerden. Durch eine Operation kann bei ca. 80 Prozent der Patient*innen mit CMI eine Verbesserung der Symptome erreicht werden.
Ähnlich verhält es sich mit der Syringomyelie. Auch dort können die Symptome stark einschränkend oder nicht einschränkend sein und Patient*innen können sich nach einer Operation potentiell erholen. Je länger eine Syringomyelie besteht, desto geringer wird allerdings das Erholungspotential, da die Syringomyelie mehr Zeit hat, Schäden im Rückenmark anzurichten.
Literatur
Weiterführende Literatur
Soleman J, Roth J, Constantini S. Direct syrinx drainage in patients with Chiari I malformation. Child’s Nerv Syst ChNS Off J Int Soc Pediatr Neurosurg. 2019;35(10):1863-1868. doi:10.1007/s00381-019-04228-7
Soleman J, Roth J, Constantini S. Syringo-subarachnoid shunt: how I do it. Acta Neurochir (Wien). 2019;161(2):367-370. doi:10.1007/s00701-019-03810-x
Soleman J, Bartoli A, Korn A, Constantini S, Roth J. Treatment failure of syringomyelia associated with Chiari I malformation following foramen magnum decompression: how should we proceed? Neurosurg Rev. 2019;42(3):705-714. doi:10.1007/s10143-018-01066-0
Soleman J, Roth J, Bartoli A, Rosenthal D, Korn A, Constantini S. Syringo-Subarachnoid Shunt for the Treatment of Persistent Syringomyelia Following Decompression for Chiari Type I Malformation: Surgical Results. World Neurosurg. 2017;108:836-843.
Bartoli A, Soleman J, Berger A, et al. Treatment Options for Hydrocephalus Following Foramen Magnum Decompression for Chiari I Malformation: A Multicenter Study. Neurosurgery. 2020;86(4):500-508. doi:10.1093/neuros/nyz211doi:10.1016/j.wneu.2017.08.002
Arachnoidalzysten
Die wichtigsten Punkte
- Arachnoidalzysten sind seltene, mit Hirnwasser gefüllte Zysten die häufig keine Behandlung brauchen.
- Meist werden Arachnoidalzysten zufällig gefunden. Symptome können Kopfschmerzen, Entwicklungsstörungen oder kognitive Störungen sein.
- Die Bildgebung mittels MRI ist die Diagnostik der Wahl.
- Arachnoidalzysten sollten nur operiert werden, wenn sie Symptome verursachen. Es gibt drei anerkannte Operationstechniken wovon die endoskopische Zystenfenestration die Methode der Wahl ist.
- Die Prognose nach einer erfolgreichen Operation ist exzellent.
Diagnose, Behandlung und Prognosen
Krankheitsbild
Was ist eine Arachnoidalzyste?
Arachnoidalzysten (AZ’s) sind mit Hirnwasser gefüllte Zysten (ein mit Flüssigkeit gefüllter "Sack") innerhalb der sogenannten Spinnenhaut (Arachnoidea), eine der Hirnhäute, die unser Gehirn umgeben. Wie es genau zu der Entstehung von AZ’skommt und wieso sie grösser werden können ist bis heute unklar. Man vermutet, dass es sich bei sogenannten primären AZ um eine Fehlentwicklung handelt, bei der es zu einer Zystenbildung im 2. oder 3. Trimester der Schwangerschaft kommt. Selten sind die AZ’s erworben, sogenannte sekundären AZ’s, zum Beispiel nach einem Schädelhirntrauma oder nach einer Hirnblutung im Frühgeborenenalter. AZ’smachen ca. 1% aller Hirnläsionen aus und kommen bei etwa 1.4%-2.6% der Bevölkerung vor, in ¾ der Fällen bei Kindern. Knaben sind häufiger betroffen als Mädchen. Prinzipiell können AZ’s überall im Gehirn vorkommen. Grob unterscheidet man zwischen AZ’s im Bereich des Grosshirns (eine sogenannte supratentorielleAZ), AZ’s im Hirnkammersystem (eine sogenannte ventrikuläre AZ) und AZ’s im Bereich des Kleinhirns (sogenannte infratentorielle AZ’s). Die Behandlung der AZ’sunterscheidet sich je nach Ort der Zyste und Art der Symptome.
Abbildung 1: Chiari I Malformation und Syringomyelie.
Symptome
Was sind typische Zeichen einer AZ?
Meist werden AZ’s per Zufall bei einer Bildgebung des Kopfes festgestellt. Da sich während der kindlichen Entwicklung das Gehirn um die Zyste herum formt und entwickelt, bleiben Symptome oder Defizite oftmals aus. Symptome kommen in ca. 7% der Fälle vor, insbesondere dann, wenn die Zyste an Grösse zunimmt und sich ein hoher Druckgradient innerhalb der Zyste bildet, was wiederum Druck auf die umliegenden Strukturen verursacht. Zusätzlich kann sich ein Hydrocephalus (Wasserkopf) bilden, was dann ebenso zu Hirndrucksymptome führen kann. Selten kann eine AZ reissen oder einbluten, was wiederum zu Symptomen führen kann. Im Falle von Symptomen treten Kopfschmerzen am häufigsten auf. Weitere Symptome sind Entwicklungsverzögerungen, neurokognitive Defizite, Krampfanfälle, Sehstörungen, Störungen des Hormonhaushaltes oder eine Vorwölbung des Schädelknochens (druckbedingt).
Diagnose
Welche weiterführende Diagnostik ist bei Verdacht auf eine AZ notwendig?
Normalerweise wird eine AZ zufällig im Rahmen einer Bildgebung des Kopfes entdeckt. Die Bildgebung der Wahl, um die AZ zu diagnostizieren und evaluieren ist die Magnet-Resonanz Tomographie (MRT). Falls die Fontanelle noch offen ist (in der Regel bis zum Alter von 6-12 Monaten), kann auch ein Ultraschall zur Diagnose verwendet werden. Vor Behandlungsbeginn sollte immer eine Bildgebung mittels MRT erfolgen. AZ’s können auch während der Schwangerschaft (intrauterin) diagnostiziert und beobachtet werden. In der Regel ist die intrauterine Diagnose einer AZ kein Grund für einen Schwangerschaftsabbruch oder für eine frühzeitige Entbindung.
Therapie
Was sind Behandlungsmöglichkeiten einer AZ?
AZ’s, die keine Symptome verursachen, werden normalerweise mittels Bildgebung nachverfolgt und es ist nur selten eine Operation notwendig. Falls die AZ grösser wird, neue Symptome auftreten, oder es zu einer Blutung oder Zystenruptur kommt, dann wird eine chirurgische Behandlung der Zyste empfohlen. Die Behandlung richtet sich nach der Lokalisation und nach den Symptomen der AZ. Das Ziel der Operation ist es, den Druck, der sich innerhalb der AZ aufgebaut hat, zu reduzieren. Prinzipiell bestehen heutzutage 3 chirurgische Möglichkeiten: eine «offene»Fenestration der AZ, eine endoskopische Zystenfenestration, oder die Einlage eines Zysto-peritonealen Shunts. In der Regel bevorzugen wir die minimal-invasive endoskopische Technik.
- Endoskopische «minimal-invasive» Technik: Bei der endoskopischen Technik wird über einen minimal invasiven Zugang die Zyste entweder mit dem normalen Hirnkammersystem (Ventrikel) verbunden, damit das Hirnwasser in die Hirnkammern fliessen und von dort aufgenommen und resorbiert werden kann. Alternativ verbinden wir die Zyste mit den sogenannten Zisternen, welche wiederrum zum äusseren Hirnkammersystem gehören, dass das Hirn umgibt. Zusätzlich kann man mit der endoskopischen Technik einen eventuellen Hydrozephalus während der gleichen Operation therapieren. Die endoskopische Technik gilt heutzutage als Methode der Wahl zur Behandlung einer AZ. Bei der endoskopischen Technik wird das Kind auf dem Rücken gelagert. Anschliessend wird ein ca. 3-4 cm grosser Hautschnitt gemacht, unter dem anschliessend ein ca. 1,3 cm grosses Loch gebohrt wird. Danach werden die Hirnhäute geöffnet und ein kleiner Schlauch, in dem das Endoskop (ein langer Stab mit einer Kamera daran) enthalten ist, in die Zyste vorgeschoben. Unter Sicht der Kamera wird ein Loch (Fenestration) zum Ventrikel oder zur Zisterne hin gemacht (sogenannte Stomie). Abschliessend wird geschaut, dass ein regelrechter Abfluss aus der AZ in das umliegende Hirnwassersystem gewährleistet ist. Danach wird das Loch imSchädelknochen verschlossen und die Haut zusammengenäht. Die ganze Operation wird mit einem computergesteuerten Navigationssystem durchgeführt, dass uns bei der Orientierung um und in der Zyste hilft, die Fenestration am richtigen Ort durchzuführen.
- Mikrochirurgische «offene» Technik: Die mikrochirurgische Technik hat dasselbe Ziel wie die endoskopische Operation. Da die endoskopische Operation minimal-invasiv ist wird sie bei uns am UKBB in der Regel bevorzugt und deshalb ist die mikrochirurgische Technik in den Hintergrund geraten. Bei der mikrochirurgischen Technik wird das Kind auf dem Rücken gelagert, ein ca. 5-6cm grosser Hautschnitt durchgeführt und ein ca. 5 Franken grosses Loch in den Schädelknochen des Kindes gebohrt.Anschliessend werden die Hirnhäute eröffnet und die AZ wird aufgeschnitten (Fenestration). Abschliessend wird geschaut, dass ein regelrechter Abflussaus der AZ in das umliegende Hirnwassersystem gewährleistet ist und der Schädelknochen sowie die Haut werden wieder verschlossen. Die ganze Operation wird mit einem computergesteuerten Navigationssystem durchgeführt, dass uns bei dem Auffinden der Zyste hilft.
- Zystoperitonealer Shunt: Der Zystoperitoneale Shunt (ZPS) war lange Zeit die Standardtherapie bei AZ, ist jedoch durch die neuroendoskopische Methodeabgelöst worden. Der ZPS wird heute vor allem in Kliniken mit wenig Expertise in der Neuroendoskopie oder in Ländern mit mangelnden Ressourcen eingesetzt. Bei einer nicht erfolgreichen endoskopischen Behandlung wird zusätzlich zu einer endoskopischen Fenestration ein ZPS eingelegt. Das Kind wird auf den Rücken gelagert und ein Hautschnitt von ca. 2-3cm wird gemacht. Danach wird ein 1.1cm grosses Loch in die Schädelkalotte gebohrt und ein Silikonkatheter in die Zyste eingeführt. Dieser Katheter wird dann an ein Ventil angeschlossen. Dieses Ventil reguliert die Menge an Flüssigkeit, die aus der Zyste in den Bauchraum abfliessen soll. Das Ventil kann mittels eines Magneten durch die Haut (ohne Operation) beliebig stark eingestellt werden. Danach wird ein zusätzlicher Silikonschlauch an das Ventil angeschlossen und unter der Haut bis in den Bauch durchgezogen und unter endoskopischer Sicht in den Bauchraum eingelegt. Somit kann Flüssigkeit aus der Zyste in den Bauchraum abgeleitet werden und dort vom Körper aufgenommen und ausgeschieden werden. Der Shunt bleibt meist lebenslänglich bestehen.
Abbildung 1: Syrinx-Technique
Spitalaufenthalt
Wie läuft der Spitalaufenthalt meines Kindes ab?
Während des gesamten Spitalaufenthaltes wird Ihr Kind von unserem Team derpädiatrischen Neurochirurgie im UKBB betreut. Ihr Kind tritt einen Tag vor der Operation ein, wird durch unser Team und die Narkoseärzte (Anästhesie) nochmals untersucht und kann dann, falls Sie dies wünschen, zuhause schlafen. Am nächsten Tag wird Ihr Kind operiert und kommt anschliessend zur Überwachung auf die Intensivpflegestation oder in den Aufwachraum. Am Operationstag steht Ihnen eine unserer Elternbegleiterinnen vom Eltern Begleitungsservice (BELOP) am UKBB zur Verfügung.
Sie begleiten die Eltern, bis das Kind eingeschlafen ist und zeigen den Eltern, wo es wieder aufwachen wird. Zwischendurch helfen sie Ihnen, sich im Spital zurechtzufinden. Komplikationen nach einer Operation von AZ sind selten. Sobald Ihr Kind keine engmaschige Überwachung mehr braucht (in der Regel am Folgetag), kommt es auf die kinderchirurgische Bettenstation. In der Regel erholt sich Ihr Kind nach 3-5 Tagen von der Operation und darf auch in diesem Zeitraum nach Hauseaustreten. Während der gesamten Zeit dürfen Sie bei Ihrem Kind sein und sich mit Fragen an das Team der pädiatrischen Neurochirurgie wenden, welches täglich zur Visite bei Ihnen und Ihrem Kind vorbeikommt.
Prognose
Was ist die Prognose einer AZ?
In der Regel sind AZ’s gutartig, d.h. wenn sie asymptomatisch sind und nicht signifikant wachsen, können sie über Jahre hinweg beobachtet werden. Falls eine Operation notwendig ist, ist die Prognose ebenfalls sehr gut, da die Komplikationsrate einer Operation sehr niedrig ist. In der Regel bleibt die AZ trotz der Operation bestehen, die Symptome bilden sich jedoch oftmals zurück da der Druck innerhalb der Zyste reduziert wurde. Selten kann sich die Öffnung, die bei der endoskopischen oder offenen Zystenfenestration gemacht wurde, wieder verschliessen.
In solchen Fällen könnte eine erneute Operation notwendig sein. Nach einem zystoperitonealen Shunt kann es zu mechanischen Problemen wie z.B. Verstopfung oder Abbruch des Katheters kommen. In diesen Fällen ist meistens eine Revisionsoperation notwendig. Nach der operativen Behandlung einer AZ braucht es keine weiteren anschliessenden Therapien. Oft erfolgt eine klinische Kontrolle für ein paar Jahren und bei einem problemlosen Verlauf kann die Behandlung abgeschlossen werden.
Literatur
Weiterführende Literatur
1. Soleman J, Kozyrev DA, Constantini S, Roth J. Surgical treatment and outcome of posterior fossa arachnoid cysts in infants. J Neurosurg Pediatr. 2021;28(5):544-552. doi:10.3171/2021.5.PEDS21119
2. https://www.paediatrieschweiz.ch/die-behandlung-von-intrakraniellen-arachnoidalzysten-in-kindern/
3. Ebel F, Greuter L, Mariani L, Guzman R, Soleman J. Intracranial Neuroendoscopy in Children and Adults: Where Do the Differences Lie? World Neurosurg. 2023 Jun 2:S1878-8750(23)00756-8. doi: 10.1016/j.wneu.2023.05.110.
Weitere Themen
Ihr Spezialisten-Team der Kinderneurochirurgie am UKBB
Prof. Dr. med. Raphael Guzman
Prof. Dr. med. Raphael Guzman - Personal - UKBB ein universitäres Kompetenzzentrum für Kinder- und Jugendmedizin - Forschung. Ihre Experten kontaktieren!
- +41 61 704 13 30 (Sekretariat)
Dr. med. Maria Licci
Oberärztin päd. Neurochirurgie
Oberärztin WirbelsäulenorthopädieLernen Sie das engagierte UKBB-Team kennen: erfahrene Ärzt*innen, einfühlsame Pflegekräften und qualifizierte Fachleuten. Erfahren Sie mehr über ihre Expertise und Leidenschaft für die Gesundheit unserer Patient*innen!
- +41 61 556 55 02 (Sekretariat)
Prof. Dr. med. Jehuda Soleman
Leitender Arzt päd. Neurochirurgie
Pädiatrische Endokrinologie & Diabetologie - Abteilungen - UKBB ein universitäres Kompetenzzentrum für Kinder- und Jugendmedizin. Ihre Experten kontaktieren!
- +41 61 704 13 30 (Sekretariat)
Für Rückfragen wenden Sie sich bitte an das jeweilige Sekretariat unseres Spezialisten-Team.
Notfälle
Beratungstelefon
für
Kinder- und Jugendnotfälle
0900 712 712 (3.23 CHF/Min., nur über private Festnetz- oder Handynummern)
0900 712 713 (3.23 CHF/Min., für Anrufe von Prepaid-Handys)
0800 444 333 (Abrechnung via Krankenkasse, für Business-Anschlüsse)
Notfall im Ausland
Bei Notfällen im Ausland rufen Sie die Notfallnummer Ihrer Kranken-kasse an. Diese finden Sie jeweils auf Ihrer Krankenkassenkarte.
Tox Info Suisse
(Gift- und Informationszentrum)
145
Kontakt
Universitäts-Kinderspital beider
Basel, Spitalstrasse 33
4056 Basel | CH
Tel. +41 61 704 12 12
Kontaktformular
Kontakt
Universitäts-Kinderspital beider
Basel, Spitalstrasse 33
4056 Basel | CH
Tel. +41 61 704 12 12
Kontaktformular
© UKBB, 2024